题目内容
1.下列关于物质的量的叙述中,错误的是( )| A. | 1mol任何粒子的粒子数叫做阿伏伽德罗常数 | |
| B. | 1molH2O中含有3mol原子 | |
| C. | 1molH2O中含有2 mol氢和1mol氧 | |
| D. | 0.012Kg12C中约含有6.02×1023个碳原子 |
分析 A.国际上规定0.012Kg12C中所含碳原子数为1mol;
B.水分子中含两个氢原子和一个氧原子;
C.物质的量需要指明表示的微粒种类;
D.国际上规定0.012Kg12C中所含碳原子数约含有6.02×1023个碳原子.
解答 解:A.国际上规定0.012Kg12C中所含碳原子数为1mol,1mol任何粒子的粒子数叫做阿伏伽德罗常数,故A正确;
B.水分子中含两个氢原子和一个氧原子,1molH2O中含有3mol原子,故B正确;
C.物质的量需要指明表示的微粒种类,2 mol氢和1mol氧指代不明,故C错误;
D.国际上规定0.012Kg12C中所含碳原子数约含有6.02×1023个碳原子,叫做阿伏伽德罗常数,故D正确;
故选C.
点评 本题考查了物质的量、阿伏伽德罗常数、物质的量和微粒数的关系等,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
11.下列各组离子在溶液中一定能大量共存的是( )
| A. | Fe3+、NH4+、Cl-、I- | B. | Cu2+、Na+、Cl-、NO3- | ||
| C. | K+、HCO3-、OH-、Ba2+ | D. | K+、CO32-、NO3-、Al3+ |
9.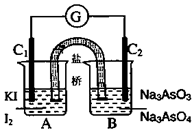 将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:
将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:
甲组:向B烧杯中逐滴加入浓盐酸
乙组:向B烧杯中逐滴加入40%NaOH溶液
下列描述中,正确的是( )
 将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:
将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:甲组:向B烧杯中逐滴加入浓盐酸
乙组:向B烧杯中逐滴加入40%NaOH溶液
下列描述中,正确的是( )
| A. | 甲组操作过程中,C1做正极 | |
| B. | 乙组操作过程中,C2做负极,电极反应式为:AsO33-+2e-+2OH-=AsO43-+H2O | |
| C. | 两次操作过程中,微安表(G)指针的偏转方向相反 | |
| D. | 甲组操作时该装置为原电池,乙组操作时该装置为电解池 |
16.交通警察使用的“司机酒后驾车检测器”是应用氧化还原反应原理制成的,其反应的化学方程式为(Cr为铬元素):4CrO3+C2H5OH+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O CrO3是一种红色固体,它在酸性条件下与酒精蒸气反应生成蓝绿色的硫酸铬,根据颜色变化来判断司机是否饮酒.下列说法不正确的是( )
| A. | CrO3是氧化剂 | |
| B. | 酒精是还原剂 | |
| C. | 当2mol CrO3被还原时,有3mol电子发生转移 | |
| D. | 当0.02mol酒精参与反应时,生成的CO2在标准状况下的体积为0.896L |
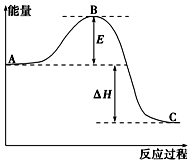 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1. 根据已学物质结构与性质的有关知识,回答下列问题:
根据已学物质结构与性质的有关知识,回答下列问题: