题目内容
13. 根据已学物质结构与性质的有关知识,回答下列问题:
根据已学物质结构与性质的有关知识,回答下列问题:(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:P,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是硒.
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+三角锥形,BF3正三角形.
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=Cu(NH3)42++2OH-.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为3$\sqrt{6}$:8.
分析 (1)第三周期元素中p轨道上有3个未成对电子,则最外层电子排布为3s23p3,外围电子排布是4s24p4,位于周期表第四周期ⅥA族;
(2)根据VSEPR模型,计算价层电子对数,据此判断分子空间构型;
(3)向硫酸铜溶液中加入氨水,氨水先和硫酸铜反应生成氢氧化铜蓝色沉淀,继续添加氨水,氨水和氢氧化铜反应生成可溶性的铜氨络合物;
(4)利用均摊法计算晶胞中含有的原子个数;晶胞的密度等于晶胞中铁原子的质量与体积的比.
解答 解:(1)第三周期元素中p轨道上有3个未成对电子,则最外层电子排布为3s23p3,应为P元素,外围电子排布是4s24p4,位于周期表第四周期ⅥA族,为硒元素,
故答案为:P; 硒;
(2)根据VSEPR模型得,H3O+的价层电子对=3+$\frac{1}{2}$(6-1-3×1)=4,有1个孤电子对,所以是三角锥形;BF3的价层电子对=3,且不存在孤电子对,所以是正三角形,
故答案为:三角锥形、正三角形;
(3)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=Cu(NH3)42++2OH-,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=Cu(NH3)42++2OH-;
(4)体心立方晶胞中铁原子个数=1+8×$\frac{1}{8}$=2;面心立方晶胞中实际含有的Fe原子个数=6×$\frac{1}{6}$+8×$\frac{1}{8}$=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;
设体心立方中晶胞的棱长为x,铁原子的直径为A,则3x2=(2A)2,解得x=$\frac{2\sqrt{3}A}{3}$;
铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长=$\sqrt{2}$A,其晶胞体积=2$\sqrt{2}$A3.
体心立方的密度与面心立方的密度之比=$\frac{2m}{{(\frac{2\sqrt{3}A}{3})}^{3}}$:$\frac{4m}{2{\sqrt{2}A}^{3}}$=3$\sqrt{6}$:8,
故答案为:1:2; 3$\sqrt{6}$:8.
点评 本题考查考查较为综合,侧重考查学生的分析、计算能力,涉及微粒的空间构型的判断、晶胞的密度等知识点,难点是计算晶胞的密度,能正确解答晶胞的体积是解本题的关键,知道体心立方和面心立方中哪三个原子紧密相连即可分析解答,难度较大.

| A. | 棕红色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 增大压强更有利于合成氨 | |
| D. | 硫酸工业上SO2氧化成SO3采用过量的空气 |
| A. | 1mol任何粒子的粒子数叫做阿伏伽德罗常数 | |
| B. | 1molH2O中含有3mol原子 | |
| C. | 1molH2O中含有2 mol氢和1mol氧 | |
| D. | 0.012Kg12C中约含有6.02×1023个碳原子 |
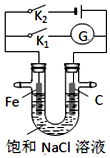
| A. | K1闭合,石墨棒周围溶液pH逐渐升高 | |
| B. | K1闭合,铁棒上发生的反应为2H++2e→H2↑ | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
| A. | 能使石蕊试液变红 | B. | 能跟磷酸钙反应制磷酸 | ||
| C. | 能跟氯化钠反应制氯化氢 | D. | 能跟锌反应产生氢气 |
 .
.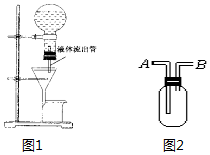 (1)某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图1所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通.
(1)某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图1所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通.