题目内容
19.如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | K | L | ||||||||||||
| M | N | ||||||||||||||||
(1)请写出元素N的基态原子电子排布式1s22s22p63s23p63d74s2或[Ar]3d74s2.
(2)元素B、G形成的单质熔点更高的是Li(填化学式),原因是Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高.
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是非极性(填“极性”或“非极性”)分子.
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有①③(填序号),CS2分子的空间构型是直线型.
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为[Co(NH3)5SO4]Br.
分析 (1)N为27号Co元素,根据核外电子排布规律书写Co基态原子电子排布式;
(2)元素B为Li,G为Na,金属键越强,金属晶体的熔点越高;
(3)根据相似相溶原理解答;
(4)根据价层电子对互斥理论确定其杂化方式;
(5)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,为配体.加入AgNO3溶液时,会产生淡黄色沉淀溴化银,说明溴离子为配合物的外界离子,据此书写.
解答 解:(1)N为27号Co元素,Co基态原子电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2,
故答案为:1s22s22p63s23p63d74s2或[Ar]3d74s2;
(2)元素B为Li,G为Na,金属键越强,金属晶体的熔点越高,Li和Na的价电子数相同,晶体中Li+离子半径比Na+小,则金属锂中金属键更强,故Li的熔点更高,
故答案为:Li;Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高;
(3)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,CCl4、CS2都是非极性溶剂,根据相似相溶原理,可判断ME2L2是非极性分子,
故答案为:非极性;
(4)①苯中每个碳原子只含3个σ键且没有孤电子对,所以属于sp2杂化;
②CH3OH中碳原子含有4个σ键且没有孤电子对,所以属于sp3杂化;
③HCHO中碳原子含有3个σ键且没有孤电子对,所以属于sp2杂化;
④CS2中碳原子含有2个σ键且没有孤电子对,所以属于sp杂化;
⑤CCl4中碳原子含有4个σ键且没有孤电子对,所以属于sp3杂化;
CS2中碳原子属于sp杂化,其结构为S=C=S,属于直线型分子;
故答案为:①③;直线型;
(5)加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,为配体,加入AgNO3溶液时,会产生淡黄色沉淀溴化银,说明溴离子为配合物的外界离子,故该配合物的结构式为[Co(NH3)5SO4]Br,故答案为:[Co(NH3)5SO4]Br.
点评 本题考查物质结构知识,知识点较综合,原子杂化方式的判断、原子核外电子排布式的书写等知识点是高考热点,应重点掌握,题目难度中等.

| 物质 | 熔点℃ | 沸点℃ | 密度g•cm-3 | 水溶性 |
| A | -98 | 57.5 | 0.93 | 可溶 |
| B | -84 | 97 | 0.90 | 可溶 |
| A. | 萃取 | B. | 升华 | C. | 分馏 | D. | 分液 |
| A. | 棉、蚕丝、合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 牛奶、鸡蛋清均可用于重金属中毒解毒 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 氨水能导电,说明氨气是电解质 |
| A. | 0.1 mol NaCN中含共价键数为0.3NA | |
| B. | 0.1 mol/L NaHCO3溶液HCO3-的数目小于0.1NA | |
| C. | 19 g H218O2含有的中子数为12NA | |
| D. | 上述反应中,当有2.24 L NH3生成时,转移电子数为0.2NA |
| A. | 戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯 | |
| B. | 分子式为C4H9Cl的有机化合物有4种 | |
| C. | 丙烯与HCl在一定条件下的产物只有一种 | |
| D. | 用CH2(NH2)-COOH和CH3-CH(NH2)-COOH两种氨基酸脱水,最多可以生成3种2肽 |
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?Ν2O4的△H<0 |
| B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 棉花与淀粉互为同分异构体 | |
| B. | 豆浆煮沸后,蛋白质变成了氨基酸 | |
| C. | 纤维素与蛋白质都是天然高分子化合物 | |
| D. | 油脂在酸性条件下可水解为高级脂肪酸盐和甘油 |
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中,溶液变黄色 | H2O2的氧化性比Fe3+强 |
| B | 将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
| C | 将某气体通入品红溶液,溶液褪色 | 气体中一定有SO2 |
| D | 将铁棒和铜棒用导线连接后放入浓硝酸中,铜棒变细 | 铜的金属性强于铁 |
| A. | A | B. | B | C. | C | D. | D |


 .
. 外,还需含苯环的二羟基化合物F,写出有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写出有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式 、
、 、
、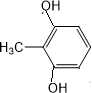 任意一种.
任意一种.