题目内容
7.2015年8月12日,天津港大爆炸造成大量危险化学品NaCN(氰化钠)的部分泄露.泄露的NaCN可用双氧水处理,其化学反应方程式:NaCN+H2O2+H2O═NaHCO3+NH3,下列有关说法正确的是( )| A. | 0.1 mol NaCN中含共价键数为0.3NA | |
| B. | 0.1 mol/L NaHCO3溶液HCO3-的数目小于0.1NA | |
| C. | 19 g H218O2含有的中子数为12NA | |
| D. | 上述反应中,当有2.24 L NH3生成时,转移电子数为0.2NA |
分析 NaCN+H2O2+H2O=NaHCO3+NH3↑反应中O元素从-1价降低为-2价,C元素从+2价升高到+4价,结合电子转移和NaCN的性质分析.
解答 解:A、0.1 mol NaCN中含0.1 mol CN-,而碳氮之间是叁键,所以总共价键数为0.3NA,故A正确;
B、体积不知,无法求物质的量,故B错误;
C、1molH218O2含中子的物质的量为20mol,而19 g H218O2的物质的$\frac{19}{38}$mol,所以19 g H218O2含有的中子数为$\frac{19}{38}$×20NA,等于10NA,故C错误;
D、状况不知无法由体积求物质的量,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的相关计算,熟练掌握以物质的量为中心的转化关系,气体摩尔体积的使用条件是解题关键,题目难度不大.

练习册系列答案
相关题目
17.下列有关实验的叙述中错误的是( )
| A. | 在蒸馏装置中,温度计水银球的位置在蒸馏烧瓶的支管口处. | |
| B. | “苯甲酸的重结晶”实验步骤是:加热溶解---趁热过滤---冷却结晶---滤出晶体 | |
| C. | 在萃取实验中,溶质在萃取剂中的溶解度小于在原溶剂中的溶解度 | |
| D. | 在过滤实验中,应做到“一贴,二低,三靠” |
15.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA | |
| D. | 一定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA |
2.下列实验设计的步骤及现象均正确的是( )
| 实验目的 | 实 验 步 骤 及 现 象 | |
| A | 证明氯水有酸性 | 试样$\stackrel{滴加紫色石蕊}{→}$溶液变红色,且长时间不变 |
| B | 检验某红棕色气体是否溴蒸汽 | 试样$\stackrel{滴入淀粉KI溶液}{→}$观察溶液是否变蓝 |
| C | 证明酸性条件 H2O2氧化性比I2强 | NaI溶液$\stackrel{加入30%H_{2}O_{2}溶液}{→}$$\stackrel{加入稀硝酸及淀粉}{→}$溶液变蓝色 |
| D | 提纯含有少量乙酸的乙酸乙酯 | 试样$\stackrel{加入过量饱和Na_{2}CO_{3}溶液}{→}$$\stackrel{静置分液}{→}$较纯净乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
12.化学来源于生活也服务于生活,下列关于生活中的化学叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆原理相似 | |
| C. | 雾霾是许多细小液体和固体微粒分散到空气中形成的一种气溶胶 | |
| D. | 光导纤维在信息领域应用越来越广泛,光导纤维的主要成分是Si单质 |
19.如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出元素N的基态原子电子排布式1s22s22p63s23p63d74s2或[Ar]3d74s2.
(2)元素B、G形成的单质熔点更高的是Li(填化学式),原因是Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高.
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是非极性(填“极性”或“非极性”)分子.
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有①③(填序号),CS2分子的空间构型是直线型.
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为[Co(NH3)5SO4]Br.
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | K | L | ||||||||||||
| M | N | ||||||||||||||||
(1)请写出元素N的基态原子电子排布式1s22s22p63s23p63d74s2或[Ar]3d74s2.
(2)元素B、G形成的单质熔点更高的是Li(填化学式),原因是Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高.
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是非极性(填“极性”或“非极性”)分子.
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有①③(填序号),CS2分子的空间构型是直线型.
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为[Co(NH3)5SO4]Br.
16.决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
A通常显+3价,B元素的核外电子排布式为1s22s22p63s2.
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),已知3种离子晶体的晶格能数据如下表:
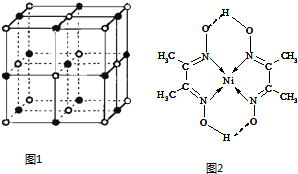
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是TiN>MgO>CaO>KCl.
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.FeCl3和CuCl2中,适合作录音带磁粉原料的是FeCl3.
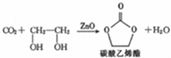
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.FeCl3和CuCl2中,适合作录音带磁粉原料的是FeCl3.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
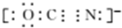 ,Y-的结构式为
,Y-的结构式为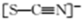 ,Z-的化学式为HF2-.
,Z-的化学式为HF2-.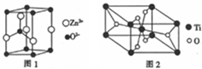

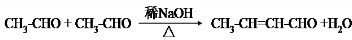 ,F 到 G 的反应类型加成反应或还原反应
,F 到 G 的反应类型加成反应或还原反应 ,姜黄素的结构简式
,姜黄素的结构简式
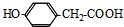 .
.