题目内容
4.下列有关实验现象和解释或结论都正确的是( )| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?Ν2O4的△H<0 |
| B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化氮为红棕色气体,加热时温度向吸热方向移动;
B.不能证明碘离子与亚铁离子的还原性强弱;
C.K2CO3、KHCO3都可与酸反应生成二氧化碳气体;
D.把SO2通入紫色石蕊试液中,溶液变为红色.
解答 解:A.二氧化氮为红棕色气体,温度高,颜色深,则2NO2?N2O4为放热反应,即△H<0,故A正确;
B.少量的溴水分别滴入FeCl2溶液、NaI溶液中,分别反应生成铁离子、碘单质,不能比较亚铁离子、碘离子的还原性,故B错误;
C.K2CO3、KHCO3都可与酸反应生成二氧化碳气体,不一定含有K2CO3,故C错误;
D.二氧化硫为酸性气体,不能漂白酸碱指示剂,把SO2通入紫色石蕊试液中,溶液变为红色,故D错误.
故选A.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
14.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )


| A. | 分子式为 C7H6O5 | |
| B. | 分子中含有 2 种官能团 | |
| C. | 可发生加成和水解反应 | |
| D. | 该有机物能发生消去反应和催化氧化反应 |
15.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA | |
| D. | 一定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA |
12.化学来源于生活也服务于生活,下列关于生活中的化学叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆原理相似 | |
| C. | 雾霾是许多细小液体和固体微粒分散到空气中形成的一种气溶胶 | |
| D. | 光导纤维在信息领域应用越来越广泛,光导纤维的主要成分是Si单质 |
19.如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出元素N的基态原子电子排布式1s22s22p63s23p63d74s2或[Ar]3d74s2.
(2)元素B、G形成的单质熔点更高的是Li(填化学式),原因是Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高.
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是非极性(填“极性”或“非极性”)分子.
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有①③(填序号),CS2分子的空间构型是直线型.
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为[Co(NH3)5SO4]Br.
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | K | L | ||||||||||||
| M | N | ||||||||||||||||
(1)请写出元素N的基态原子电子排布式1s22s22p63s23p63d74s2或[Ar]3d74s2.
(2)元素B、G形成的单质熔点更高的是Li(填化学式),原因是Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高.
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是非极性(填“极性”或“非极性”)分子.
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有①③(填序号),CS2分子的空间构型是直线型.
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为[Co(NH3)5SO4]Br.
9.在反应3Fe3O4+28HNO3═9Fe(NO3)3+NO+14H2O中,还原剂和氧化剂的物质的量之比是( )
| A. | 3:28 | B. | 3:1 | C. | 9:28 | D. | 1:3 |
16.决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
A通常显+3价,B元素的核外电子排布式为1s22s22p63s2.
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),已知3种离子晶体的晶格能数据如下表:
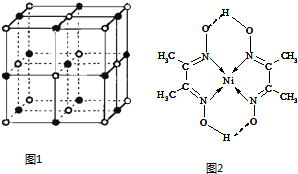
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是TiN>MgO>CaO>KCl.
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.FeCl3和CuCl2中,适合作录音带磁粉原料的是FeCl3.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.FeCl3和CuCl2中,适合作录音带磁粉原料的是FeCl3.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
13.25℃时,某溶液中可能含有以下几种离子:Na+、H+、Fe3+、HCO${\;}_{3}^{-}$、OH-、I-.已知溶液中由水电离出的c(H+)=10-13mol•L-1,向该溶液中通入一定量的Cl2后,溶液由无色变为黄色,下列有关该溶液的说法中正确的是( )
| A. | 该溶液的pH一定等于1 | |
| B. | 阴离子肯定有I-,不能确定有无HCO${\;}_{3}^{-}$ | |
| C. | 阳离子肯定没有Fe3+,一定有Na+ | |
| D. | 该溶液含有的溶质成分可能为HI;或HI和NaI;或NaI和NaOH |

 ;
; ;
;