题目内容
15.如图所示的实验,发现烧杯中酸性KMn04溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeS04溶液,溶液呈血红色.判断下列说法中不正确的是( )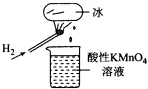
| A. | 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 | |
| B. | 该条件下H2燃烧的产物中可能含有一定量的H2O2、HO2等 | |
| C. | 将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性 | |
| D. | 酸性FeSO4溶液中加入双氧水的离子反应为:2Fe 2++H2O2+2H+=2Fe3++2H20 |
分析 氢气在空气中燃烧,产物遇冰块冷凝滴入烧杯中.据紫色的KMnO4溶液具有强氧化性,若使其褪色,必定有还原性物质滴入杯中;使FeS04、KSCN混合溶液变红,必定有氧化性物质将Fe2+氧化.从而确定这一冷凝产物既有氧化性又有还原性,根据氧元素的化合价可知该物质可能是HO2、H2O2,以此解答该题.
解答 解:A.烧杯中酸性KMnO4溶液褪色,说明H2燃烧的产物中可能有还原性物质.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液呈血红色,说明有Fe3+生成,进而说明H2燃烧的产物中可能有氧化性物质,由此说明H2燃烧的产物有还原性和氧化性,故A正确;
B.根据氧元素的化合价可知HO2、H2O2具有氧化性与还原性,遇强氧化剂是表现还原性,遇较强的还原剂是表现氧化性,故B正确;
C.KI淀粉溶液中的KI具有还原性,能验证生成物具有氧化性,故C错误;
D.过氧化氢具有氧化性,可在酸性条件下氧化亚铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H20,故D正确.
故选C.
点评 本题以信息题的形式考查氧化还原反应,为高考常见题型,题目侧重于学生的分析能力的考查,注意把握物质的性质,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列说法中,在科学上没有错误的是( )
| A. | 吸带过滤嘴的香烟,对人体无害 | |
| B. | 人工合成的具有生命活性的蛋白质-结晶牛胰岛素,是1965年我国科学家最先合成的 | |
| C. | 纯天然物质配成的饮料,不含任何化学物质 | |
| D. | 蒸馏水绝对纯净,其中不含任何分子 |
6.化学与生产、生活、社会密切相关.下列有关说法中正确的是( )
| A. | 加碘食盐中碘以单质形式存在 | |
| B. | NaHCO3可以与胃酸反应,用来治疗胃酸过多 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化、杀菌消毒 |
3.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.该反应为吸热反应(选填“吸热”、“放热”).
(2)能判断该反应是否已达化学平衡状态的依据是bc.
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡不移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为830℃.
(7)若在(6)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b.
a.等于1.0mol b.大于1.0molc.大于0.5mold.无法确定.
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)能判断该反应是否已达化学平衡状态的依据是bc.
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡不移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为830℃.
(7)若在(6)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b.
a.等于1.0mol b.大于1.0molc.大于0.5mold.无法确定.
10.下列每组反应一定能用同一离子方程式表示的是( )
| A. | CuO分别与稀硫酸、稀盐酸反应 | |
| B. | CaCO3、Na2CO3分别与盐酸反应 | |
| C. | H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 | |
| D. | Na分别与水、稀盐酸反应 |
20.用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度.则电解过程中转移的电子的物质的量为( )
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
7.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )
| A. | c(A-)≥c(M+) | B. | c(A-)≤c(M+) | ||
| C. | 若MA不水解,则c(OH-)=c(A-) | D. | 若MA水解,则c( OH-)>c(A-) |
4.下列说法中错误的是( )
| A. | 烯烃各同系物中碳的质量分数相等 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 分子量相同的两种物质不一定是同分异构体 | |
| D. | C2H6和C4H10一定是同系物 |
5.在pH=0的无色溶液中能大量共存的离子组是( )
| A. | Na+、Ca2+、Cl-、AlO2- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+.、Mg2+、SO42-、Cl- |