题目内容
3.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)能判断该反应是否已达化学平衡状态的依据是bc.
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡不移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为830℃.
(7)若在(6)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b.
a.等于1.0mol b.大于1.0molc.大于0.5mold.无法确定.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应;
(2)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(3)其他条件不变的情况下,扩大容器的体积,压强减小,平衡向气体体积增大的方向移动;
(4)平衡常数只受温度影响,温度不变平衡常数不变;
(5)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(6)计算平衡时各组分浓度,再根据k=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$计算平衡常数判断温度;
(7)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 3 0 0
变化(mol):y y y y
平衡(mol):2-y 3-y y y
再根据平衡常数k=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$=2.6列方程计算解答.
解答 解:(1)可逆反应CO2(g)+H2(g)?CO(g)+H2O(g)的化学平衡常数表达式k=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,
由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,温度升高平衡向吸热反应移动,故该反应正反应是吸热反应,
故答案为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;吸热;
(2)a.该可逆反应反应前后气体的物质的量不变,容器内压强自始至终不变,容器中压强变,不能说明反应到达平衡,故a错误;
b.随反应进行CO的浓度增大,混合气体中 c(CO)不变,说明反应到达平衡,故b正确;
c.υ正(H2)=υ逆(H2O),不同物质表示的正逆反应速率之比等于化学计量数之比,说明反应到达平衡,故c正确;
d.c(CO2)=c(CO)时可能处于平衡状态,可能不处于平衡状态,与反应的条件有关,即与二氧化碳的转化率有关,故d错误;
故选:bc;
(3)其他条件不变的情况下,扩大容器的体积,压强减小,反应气体气体体积不变,平衡不移动,
故答案为:不;
(4)由表中数据可知,830℃时该平衡常数为1,平衡常数只受温度影响,与物质的浓度无关,温度不变平衡常数不变,
故答案为:等于;
(5)浓度商Qc=$\frac{4×4}{2×2}$=4>K=2.6,反应向逆反应方向进行,
故答案为:逆反应方向;
(6)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
起始浓度(mol):0.5 0.5 0 0
变化浓度(mol):0.25 0.25 0.25 0.25
平衡浓度(mol):0.25 0.25 0.25 0.25
故平衡常数K=$\frac{0.25×0.25}{0.25×0.25}$=1,故所处温度为830℃,
故答案为:830;
(7)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 3 0 0
变化(mol):y y y y
平衡(mol):2-y 3-y y y
则平衡常数K=$\frac{y×y}{(2-y)×(3-y)}$=1,解得y=1.2,故平衡时H2的物质的量为3mol-1.2mol=1.8mol,
故选:b.
点评 本题考查化学平衡计算、化学平衡常数、化学平衡状态的判断,难度中等,掌握化学平衡常数的书写及用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

| A. | 中性重水的pD值为7 | |
| B. | 在1L重水中溶解0.01molDCl,其pD值为4 | |
| C. | 在1L重水中溶解0.01mol NaOD,其pD值为12 | |
| D. | 在100mL 0.25mol/L的DCl重水溶液中加入50mL0.2mol/L的NaOD的重水溶液时,其pD值为1 |

| A. | M可能为铜,X可能为氯化铁 | B. | M可能为石墨,Y可能为硫酸铁 | ||
| C. | 电子由铁经盐桥流向M极 | D. | 盐桥中K+向铁极迁移 |
| A. | 能使甲基橙变红的溶液中:NH4+、Mg2+、SO42-、NO3- | |
| B. | 1.0 mol•L-1FeCl3溶液:Na+、Cl-、NO3-、SCN- | |
| C. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、SO42- | |
| D. | 与Al反应能放出H2的溶液中:Na+、Cl-、HCO3-、SO42- |
| A. | HSO4-、Na+、OH-、K+ | B. | HCO3-、NO3-、Mg2+、Ba2+ | ||
| C. | Ba2+、Mg2+、NO3-、Cl- | D. | Mg2+、Na+、Cl-、SO42- |
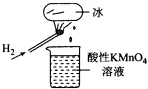
| A. | 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 | |
| B. | 该条件下H2燃烧的产物中可能含有一定量的H2O2、HO2等 | |
| C. | 将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性 | |
| D. | 酸性FeSO4溶液中加入双氧水的离子反应为:2Fe 2++H2O2+2H+=2Fe3++2H20 |
| 编码 | 实验 | 现象 |
| A | 加热放在坩埚中的小块钠 | 钠先融化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔融化,失去光泽,融化的铝并不滴落,好像一层膜兜着 |
| C | 在空气中久置的铝条放入NaOH溶液中 | 铝条立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| D | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |



