题目内容
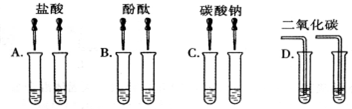
10.下列每组反应一定能用同一离子方程式表示的是( )| A. | CuO分别与稀硫酸、稀盐酸反应 | |
| B. | CaCO3、Na2CO3分别与盐酸反应 | |
| C. | H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 | |
| D. | Na分别与水、稀盐酸反应 |
分析 A.CuO分别与稀硫酸、稀盐酸反应实质都是,氧化铜与氢离子反应生成铜离子和水;
B.碳酸钙为沉淀保留化学式,碳酸钠应拆成离子形式;
C.硫酸与氢氧化钡溶液反应除了生成硫酸钡沉淀,还生成了水;
D.钠与盐酸反应生成氯化钠和氢气,钠与水反应生成氢氧化钠和氢气.
解答 解:A.CuO分别与稀硫酸、稀盐酸反应实质都是氧化铜与氢离子反应生成铜离子和水,其离子方程式都是:CuO+2H+=H2O+Cu2+,故A正确;
B.碳酸钙与盐酸反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,而碳酸钠与盐酸反应的离子方程式为:2H++CO32-=H2O+CO2↑,不能用同一离子方程式表示,故B错误;
C.硫酸与氢氧化钡反应的离子方程式为2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O,硫酸钾与氢氧化钡反应的离子方程式为:SO42-+Ba2+=BaSO4↓,不能用同一离子方程式表示,故C错误;
D.钠与盐酸反应的离子方程式为:2Na+2H+=2Na++H2↑,钠与水反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,不能用同一离子方程式表示,故D错误;
故选A.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式;明确离子方程式表示的意义为解答关键.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
3.在恒温条件下,能使 A(g)+B(g)?C(g)+D(g)正反应速率增大的措施是( )
| A. | 减小C 或D 的浓度 | B. | 增大压强 | ||
| C. | 减小B 的浓度 | D. | 增大 A 或B的浓度 |
18.向某无色透明溶液中加入铝粉,能放出氢气,则此溶液中可能大量共存的离子组是( )
| A. | HSO4-、Na+、OH-、K+ | B. | HCO3-、NO3-、Mg2+、Ba2+ | ||
| C. | Ba2+、Mg2+、NO3-、Cl- | D. | Mg2+、Na+、Cl-、SO42- |
5.下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
| A. | H2SO4、K、HCl | B. | Cl2、Al、H2 | C. | NO2、Na、Br2 | D. | O2、SO2、H2O |
15.如图所示的实验,发现烧杯中酸性KMn04溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeS04溶液,溶液呈血红色.判断下列说法中不正确的是( )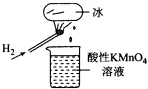

| A. | 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 | |
| B. | 该条件下H2燃烧的产物中可能含有一定量的H2O2、HO2等 | |
| C. | 将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性 | |
| D. | 酸性FeSO4溶液中加入双氧水的离子反应为:2Fe 2++H2O2+2H+=2Fe3++2H20 |
20. 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.
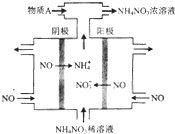
(1)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是:根据反应:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据.
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.15mol/(L.min);n3=n4(填“>”、“<”或“=”),该反应的平衡常数的值为2.8.
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.
 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.(1)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是:根据反应:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.