题目内容
5.对于锌、铜和稀硫酸构成的原电池,下列有关说法正确的是( )①Zn是负极
②Cu是正极
③负极反应:Zn-2e-=Zn2+
④正极反应:Cu2++2e-=Cu
⑤H+向负极移动
⑥电子由Cu极通过导线向Zn极移动.
| A. | 仅①②③⑤ | B. | ①②③④⑤ | C. | 仅②③④⑥ | D. | 仅①②③ |
分析 锌、铜和稀硫酸组成的原电池中,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为正极,正极发生还原反应,氢离子得到电子生成氢气,电解方程式为2H++2e-=H2↑,阳离子向正极移动,电子由负极经外电路流向正极,以此解答该题.
解答 解:锌比铜活泼,锌为负极,铜为正极,负极电极方程式为Zn-2e-═Zn2+,正极为2H++2e-=H2↑,氢离子向正极移动,电子由负极锌流向正极铜,则正确的为①②③,
故选D.
点评 本题考查原电池知识,侧重于基础知识的考查,有利于培养学生的良好科学素养和提高学生学习的积极性,注意把握原电池的工作原理,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列化学用语表达正确的是( )
| A. | 二氧化碳的电子式: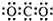 | |
| B. | 氯离子的结构示意图: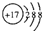 | |
| C. | NaH与重水反应的化学方程式:NaH+D2=NaOH+D2 | |
| D. | 质量数为18的氧原子:${\;}_{6}^{18}$O |
13.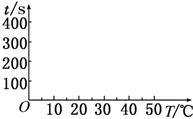 在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
(1)反应的离子方程式是Zn+2H+═Zn2++H2↑,该反应为放热反应(填“放热”或“吸热”).
(2)t1=50s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍.
(4)t1>(填“>”或“<”)t4,原因是G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快.
t2>t3(填“>”或“<”),原因是F组中锌为粉末状,表面积较大,反应速率较快.
 在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
在锌与盐酸反应的实验中,某同学得到的结果如下表所示:| 锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(2)t1=50s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍.
(4)t1>(填“>”或“<”)t4,原因是G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快.
t2>t3(填“>”或“<”),原因是F组中锌为粉末状,表面积较大,反应速率较快.
20.关于${\;}_{92}^{235}$U和${\;}_{92}^{238}$U的说法正确的是( )
| A. | 它们都含有 92个中子 | B. | 235U原子核外有143个电子 | ||
| C. | 它们互为同位素 | D. | 它们是同种核素 |
17.关于萃取实验的叙述错误的是( )?
| A. | 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层则从上口倒出 | |
| C. | 萃取、分液前需对分液漏斗进行检漏 | |
| D. | 选用酒精萃取碘水中的碘单质 |
14.下列各分子中,所有原子都满足最外层为8电子结构的是( )
| A. | H2O | B. | XeF4 | C. | Cl2 | D. | PCl5 |
15.下列关于原电池的说法正确的是( )
| A. | 在正极上发生氧化反应 | B. | 化学性质较活泼的金属为负极 | ||
| C. | 在外电路,电子流出正极 | D. | 是由电能转化为化学能的装置 |
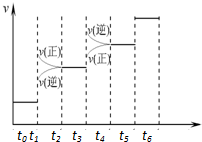 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1.请回答:(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是增大压强.其中表示平衡混合物中NH3的含量最高的一段时是t2-t3.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1.请回答:(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是增大压强.其中表示平衡混合物中NH3的含量最高的一段时是t2-t3. ,该化合物的电子式为
,该化合物的电子式为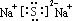 .
.