题目内容
13. 在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
在锌与盐酸反应的实验中,某同学得到的结果如下表所示:| 锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
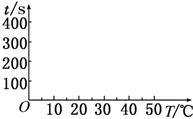
(2)t1=50s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍.
(4)t1>(填“>”或“<”)t4,原因是G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快.
t2>t3(填“>”或“<”),原因是F组中锌为粉末状,表面积较大,反应速率较快.
分析 (1)Zn与盐酸反应生成氯化锌和氢气,放出热量;
(2)由A、B、C、D中的实验可知,温度每升高10℃时,时间减少一半;
(3)由数据可知,温度高,反应速率大;
(4)D与G相比较,G中构成原电池,反应速率快;
E与F相比较,接触面积大的反应速率快.
解答 解:(1)Zn与盐酸反应生成氯化锌和氢气,离子反应为Zn+2H+═Zn2++H2↑,放出热量,为放热反应,故答案为:Zn+2H+═Zn2++H2↑; 放热;
(2)由A、B、C、D中的实验可知,温度每升高10℃时,时间减少一半,则t1=100s×$\frac{1}{2}$=50s,时间对温度的曲线图为 ,
,
故答案为:50; ;
;
(3)该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍,故答案为:温度每升高10℃,反应速率加快到原来的2倍;
(4)G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快,则t1>t4;F组中锌为粉末状,表面积较大,反应速率较快,则t2>t3,
故答案为:>;G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快;>;F组中锌为粉末状,表面积较大,反应速率较快.
点评 本题考查化学反应速率的影响因素,为高频考点,把握常见的影响速率的因素及控制变量法实验为解答的关键,侧重分析与应用能力的考查,注重迁移应用能力的训练,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
3.H2O2是实验室常用的一种化学试剂.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)实验①和②的目的是_探究H2O2溶液的浓度的变化对分解速率的影响,
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图甲.分析图甲能够得出的结论是图象显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱
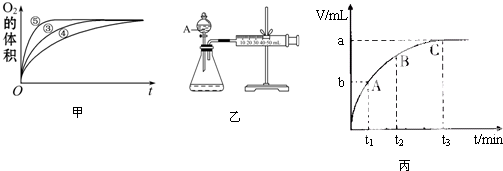
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图乙所示的实验装置进行实验.
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率.
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图丙所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的瞬时速率.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图甲.分析图甲能够得出的结论是图象显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱

(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图乙所示的实验装置进行实验.
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率.
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图丙所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的瞬时速率.
4.下列有机物的命名正确的是( )
| A. |  2.3-二乙基丁烷 | B. |  2-丁醇 | C. |  二氯丙烷 | D. |  3-甲基-2-丁烯 |
8.银锌钮扣高能电池放电时的反应为:Zn+Ag2O═ZnO+2Ag,下列说法中不正确的是( )
| A. | 若电解质溶液为KOH溶液,则电池工作一段时间后pH有明显变化 | |
| B. | Zn作负极,被氧化 | |
| C. | Ag2O在正极上发生还原反应 | |
| D. | 电解质溶液中的阴离子移向负极 |
5.对于锌、铜和稀硫酸构成的原电池,下列有关说法正确的是( )
①Zn是负极
②Cu是正极
③负极反应:Zn-2e-=Zn2+
④正极反应:Cu2++2e-=Cu
⑤H+向负极移动
⑥电子由Cu极通过导线向Zn极移动.
①Zn是负极
②Cu是正极
③负极反应:Zn-2e-=Zn2+
④正极反应:Cu2++2e-=Cu
⑤H+向负极移动
⑥电子由Cu极通过导线向Zn极移动.
| A. | 仅①②③⑤ | B. | ①②③④⑤ | C. | 仅②③④⑥ | D. | 仅①②③ |

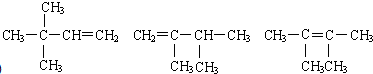 任意一种(写出其中一种即可).
任意一种(写出其中一种即可).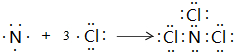 ;
;