题目内容
17.关于萃取实验的叙述错误的是( )?| A. | 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层则从上口倒出 | |
| C. | 萃取、分液前需对分液漏斗进行检漏 | |
| D. | 选用酒精萃取碘水中的碘单质 |
分析 A.利用压强差将分液漏斗中液体顺利流出;
B.分液时,分液漏斗中上层液体从上口倒出,为防止含有杂质,下层液从下口倒出;
C.有活塞或连接的装置使用前要检漏;
D.互不相溶的液体采用萃取分液的方法分离.
解答 解:A.利用压强差将分液漏斗中液体顺利流出,所以为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下,否则液体不易流出,故A正确;
B.分液时,分液漏斗中上层液体从上口倒出,为防止含有杂质,下层液从下口倒出,故B正确;
C.有活塞或连接的装置使用前要检漏,分液漏斗含有活塞,所以使用前要检漏,否则实验易失败,故C正确;
D.互不相溶的液体采用分液的方法分离,酒精和水互溶,所以不能用来萃取碘水中的碘,故D错误.
故选D.
点评 本题考查分液,侧重考查学生对实验操作的掌握,根据物质的性质确定物质分离方法,物质分离方法有分液、蒸馏、过滤、渗析等,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.银锌钮扣高能电池放电时的反应为:Zn+Ag2O═ZnO+2Ag,下列说法中不正确的是( )
| A. | 若电解质溶液为KOH溶液,则电池工作一段时间后pH有明显变化 | |
| B. | Zn作负极,被氧化 | |
| C. | Ag2O在正极上发生还原反应 | |
| D. | 电解质溶液中的阴离子移向负极 |
5.对于锌、铜和稀硫酸构成的原电池,下列有关说法正确的是( )
①Zn是负极
②Cu是正极
③负极反应:Zn-2e-=Zn2+
④正极反应:Cu2++2e-=Cu
⑤H+向负极移动
⑥电子由Cu极通过导线向Zn极移动.
①Zn是负极
②Cu是正极
③负极反应:Zn-2e-=Zn2+
④正极反应:Cu2++2e-=Cu
⑤H+向负极移动
⑥电子由Cu极通过导线向Zn极移动.
| A. | 仅①②③⑤ | B. | ①②③④⑤ | C. | 仅②③④⑥ | D. | 仅①②③ |
9.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )
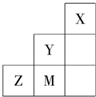

| A. | M、Z可形成ZM2分子 | B. | X原子最外层达到8电子结构 | ||
| C. | 原子半径:Z>M>Y | D. | Z2-的结构示意图可表示为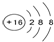 |
7.下列有关叙述正确的是( )
| A. | 因为C和Si是同主族元素,故CO2和SiO2形成的晶体相同 | |
| B. | 在晶体中有阳离子就一定有阴离子 | |
| C. | 由于水分子间可以形成氢键故水分子的稳定性很强 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
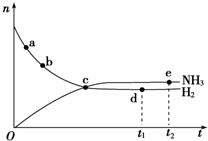 氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为: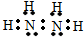 该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.
该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O. 任意一种(写出其中一种即可).
任意一种(写出其中一种即可).