题目内容
15.下列化学用语表达正确的是( )| A. | 二氧化碳的电子式: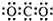 | |
| B. | 氯离子的结构示意图: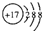 | |
| C. | NaH与重水反应的化学方程式:NaH+D2=NaOH+D2 | |
| D. | 质量数为18的氧原子:${\;}_{6}^{18}$O |
分析 A.二氧化碳分子中含有两个碳氧双键,C原子最外层达到8电子稳定结构;
B.氯离子的核电荷数为17,核外电子总数为18,最外层满足8电子稳定结构;
C.NaH与重水反应生成的氢气为HD;
D.氧元素的质子数为8,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故A错误;
,故A错误;
B.氯离子的核电荷数为17,最外层达到8电子稳定结构,其离子结构示意图为: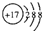 ,故B正确;
,故B正确;
C.NaH与重水(D2O)反应中,NaH中-1价H失去电子变成0价,D2O中1个+1价D得到电子变成0价,反应的化学方程式为:NaH+D2=NaOD+HD↑,故C错误;
D.氧原子的质子数为8,质量数为18的氧原子可以表示为:188O,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及离子结构示意图、电子式、元素符号、氧化还原反应等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
17.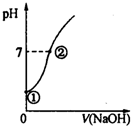 常温下,向饱和氯水中逐滴滴入0.10mol•L-1的氢氧化钠溶液,溶液的pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.10mol•L-1的氢氧化钠溶液,溶液的pH变化如图所示,下列有关叙述正确的是( )
 常温下,向饱和氯水中逐滴滴入0.10mol•L-1的氢氧化钠溶液,溶液的pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.10mol•L-1的氢氧化钠溶液,溶液的pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HClO的电离平衡 | |
| B. | 水的电离程度:①>② | |
| C. | I-在②点所示溶液中能稳定存在 | |
| D. | ②点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
3.H2O2是实验室常用的一种化学试剂.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)实验①和②的目的是_探究H2O2溶液的浓度的变化对分解速率的影响,
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图甲.分析图甲能够得出的结论是图象显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱
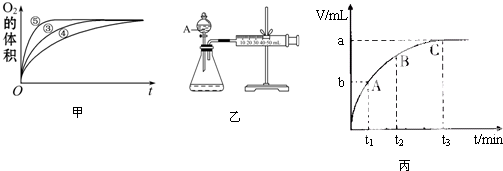
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图乙所示的实验装置进行实验.
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率.
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图丙所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的瞬时速率.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图甲.分析图甲能够得出的结论是图象显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱

(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图乙所示的实验装置进行实验.
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率.
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图丙所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的瞬时速率.
10.草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
【实验1】甲同学用8.00mL 0.001mol/L KMnO4溶液与5.00mL 0.01mol/LH2C2O4溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究温度对化学反应速率的影响,可用实验Ⅰ和Ⅱ作对比(用Ⅰ~Ⅲ表示).
(2)对比实验Ⅰ和Ⅲ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(1)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(2)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
【实验1】甲同学用8.00mL 0.001mol/L KMnO4溶液与5.00mL 0.01mol/LH2C2O4溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL 蒸馏水 |
(2)对比实验Ⅰ和Ⅲ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(1)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(2)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
20.下列各组的电极材料和电解液,不能组成原电池的是( )
| A. | 铜片、银片,FeCl3溶液 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、石墨棒,稀硫酸 |
4.下列有机物的命名正确的是( )
| A. |  2.3-二乙基丁烷 | B. |  2-丁醇 | C. |  二氯丙烷 | D. |  3-甲基-2-丁烯 |
5.对于锌、铜和稀硫酸构成的原电池,下列有关说法正确的是( )
①Zn是负极
②Cu是正极
③负极反应:Zn-2e-=Zn2+
④正极反应:Cu2++2e-=Cu
⑤H+向负极移动
⑥电子由Cu极通过导线向Zn极移动.
①Zn是负极
②Cu是正极
③负极反应:Zn-2e-=Zn2+
④正极反应:Cu2++2e-=Cu
⑤H+向负极移动
⑥电子由Cu极通过导线向Zn极移动.
| A. | 仅①②③⑤ | B. | ①②③④⑤ | C. | 仅②③④⑥ | D. | 仅①②③ |
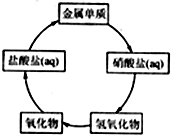 在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( )
在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( ) 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题: