题目内容
20.用图所示装置进行实验,下表中所得结论正确的是( )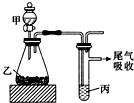
| 甲 | 乙 | 丙 | 结论 | |
| A | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.分别发生复分解反应和加成反应,不能比较稳定性;
B.硫化氢与溴发生氧化还原反应,但不能比较Cl-、Br-的还原性;
C根据氧化剂氧化性大于氧化产物的氧化性比较;
D.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与苯酚钠溶液反应.
解答 解:A.分别发生复分解反应和加成反应,不能比较稳定性,故A错误;
B.硫化氢与溴发生氧化还原反应,没有涉及Cl-、Br-的还原性比较,不能比较Cl-、Br-的还原性,故B错误;
C.高锰酸钾氧化浓盐酸生成氯气,氯气置换出溴,可说明氧化性高锰酸钾>Cl2>Br2,故C正确;
D.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与苯酚钠溶液反应,则该实验不能比较H2CO3、苯酚的酸性,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
17.实验室中需要配制2mol/L的NaOH溶液850mL,配制时应选用的容量瓶的规格和称取的NaOH的质量分别是( )
| A. | 950 mL,76 g | B. | 500 mL,80 g | C. | 1000 mL,80 g | D. | 1000 mL,76 g |
15. 2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.
2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.
(1)该反应是放热反应(填“放热”或“吸热”).
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是0.08mol.
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法.
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是ac(填序号).
a. c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
b. c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
c. c(NH4+)>c(SO32-)>c(OH-)>c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4.
a. 得到MnSO4的化学方程式是H2O+SO2=H2SO3、MnO2+H2SO3=MnSO4+H2O.
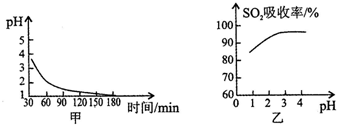
b.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙. 图甲中pH变化是因为吸收中有部分SO2被氧气氧化转化为H2SO4,生成H2SO4反应的化学方程式是2SO2+O2+2H2O=2H2SO4;由图乙可知pH的降低不利于SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是溶液中存在SO2+H2O?H2SO3?H++HSO3-,当溶液中酸性增强,平衡向左移动,使SO2气体从体系中逸出..
 2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.
2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.| 温度/ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是0.08mol.
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法.
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是ac(填序号).
a. c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
b. c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
c. c(NH4+)>c(SO32-)>c(OH-)>c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4.
a. 得到MnSO4的化学方程式是H2O+SO2=H2SO3、MnO2+H2SO3=MnSO4+H2O.
b.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙. 图甲中pH变化是因为吸收中有部分SO2被氧气氧化转化为H2SO4,生成H2SO4反应的化学方程式是2SO2+O2+2H2O=2H2SO4;由图乙可知pH的降低不利于SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是溶液中存在SO2+H2O?H2SO3?H++HSO3-,当溶液中酸性增强,平衡向左移动,使SO2气体从体系中逸出..
12.下列反应属于氧化还原反应的是( )
| A. | CO2+H2O=H2CO3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO | ||
| C. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$NaCl |



