题目内容
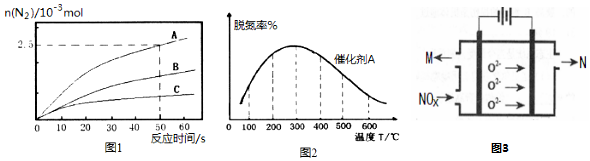
1. 已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示:
已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示:回答问题:
(1)写出该反应的化学方程式A(g)+3B(g) $\stackrel{催化剂}{?}$ 2C(g);
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从小到大排列次序为vⅢ(A)<vⅡ(A)<vⅠ(A);
(3)由第二次平衡到第三次平衡,平衡移动的方向是(填“正向移动”“逆向移动”“不移动”),改变的条件是平衡正向移动;降低温度或移出了C;
(4)在Ⅰ阶段20min时,若在恒温恒压条件下再向该体系中通入3mol A,1mol B,2molC,则化学平衡逆向移动(填“正向移动”“逆向移动”“不移动”或“无法确定”).
分析 (1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,根据浓度变化量之比等于化学计量数之比计算;
(2)根据化学反应速率为单位时间浓度的变化值,可计算三个阶段用A表示的化学反应速率,据此判断;
(3)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动;
(4)计算反应在该温度下平衡常数,若在恒温恒压条件下再向该体系中通入3mol A,1mol B,2molC,计算此时的浓度商和平衡常数比较判断反应进行的方向.
解答 解:(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,故a:b:c=1mol/L:3mol/L:2mol/L=1:3:2,化学方程式为:A(g)+3B(g) $\stackrel{催化剂}{?}$ 2C(g),
故答案为:A(g)+3B(g) $\stackrel{催化剂}{?}$ 2C(g);
(2)vⅠ(A)=$\frac{1mol/L}{20min}$=0.05mol/(L•min),vⅡ(A)=$\frac{1mol/L-0.62mol/L}{15min}$=0.0253mol/(L•min),
vⅢ(A)=$\frac{0.62mol/L-0.5mol/L}{10min}$=0.012mol/(L•min),
故A的平均反应速率vⅢ(A)<vⅡ(A)<vⅠ(A),
故答案为:vⅢ(A)<vⅡ(A)<vⅠ(A);
(3)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动,反应为放热反应,降低温度平衡正向进行,
故答案为:平衡正向移动;降低温度或移出了C;
(4)该温度下化学平衡常数K=$\frac{{2}^{2}}{{3}^{3}×1}$=$\frac{4}{27}$,恒压条件下通入3mol A,1mol B,2 molC,体积增大到原来2倍,Qc=$\frac{(\frac{2+2}{2})^{2}}{(\frac{1+3}{2})×(\frac{3+1}{2})^{3}}$=$\frac{4}{16}$,所以平衡逆向移动,
故答案为:逆向移动.
点评 本题考查了化学平衡的影响因素、反应速率计算、平衡常数计算,主要是图象的变化分析判断,掌握基础是解题关键,题目难度中等.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案| A. | 使用新能源,减少化石燃料的燃烧,可防止酸雨的产生 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 建设三峡大坝使用了大量水泥,水泥是使用量最大的无机非金属材料之一 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
| A. | 食醋可用于除去暖水瓶中的水垢 | B. | 纯碱可除去灶具上的油污 | ||
| C. | 酒精可用于杀菌消毒 | D. | 单质硅可用作光缆 |
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 用加热的方法可除去KNO3溶液中混有的Fe3+ | |
| D. | Na2CO3溶液加水稀释后,恢复至室温,pH和KW均减小 |
| A. | 少量AlCl3溶液滴入过量的NaOH溶液中:Al3++4OH-=AlO2-+2H2O | |
| B. | 将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+=Cu+2Na+ | |
| C. | FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ | |
| D. | 氯气溶解于水:Cl2+H2O?2H++Cl-+ClO- |
| A. | 4mol浓盐酸与足量的二氧化锰反应生成1mol氯气 | |
| B. | 青铜是我国使用最早的合金,它的硬度和熔点都比铜的大 | |
| C. | 二氧化硅导电性能好,可用作光导纤维 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
| A. | SO2的摩尔质量是64 g | |
| B. | 标准状况下18 g水的体积是22.4 L | |
| C. | 14g N2含有的分子数为0.5NA | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):