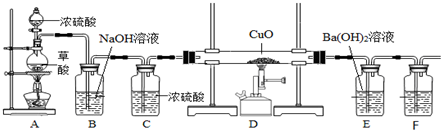
题目内容
5.已知某链状高分子化合物结构简式为: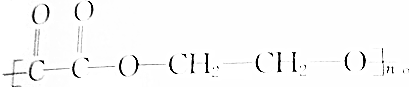 ,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )
,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )| A. | 2mol | B. | 4mol | C. | 2nmol | D. | 4nmol |
分析 根据结构简式知,乙二酸和乙二醇发生缩聚反应生成该高分子化合物,所以生成该高聚物的单体分别是HOOCCOOH、HOCH2CH2OH,该物质水解生成的羧基能和NaOH反应,据此分析解答.
解答 解:根据结构简式知,乙二酸和乙二醇发生缩聚反应生成该高分子化合物,所以生成该高聚物的单体分别是HOOCCOOH、HOCH2CH2OH,该物质水解生成的羧基能和NaOH反应,1mol该物质水解能生成2nmol羧基,所以最多消耗NaOH的物质的量为2nmol,故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查酯的水解反应,明确该物质水解生成几个羧基是解本题关键,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
15.向5.8g某饱和一元醛中加入足量的银氨溶液,在一定条件下充分反应后析出21.6g银,该醛是( )
| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
16.卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
回答下列问题:
(1)溴原子的价层电子排布图为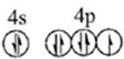 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合(HF)2形式存在,使氟化氢分子缔合的相互作用是氢键.碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:CsICl2$\frac{\underline{\;\;△\;\;}}{\;}$CsCl+ICl.
(3)ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-具有相同空间构型和键合形式的物质化学式为(写出一个即可)Cl2O、OF2等.
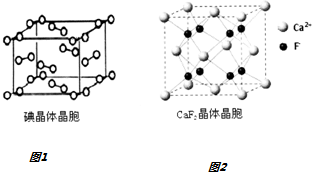
(4)如图1为碘晶体胞结构,平均每个晶胞中有8个碘原子,碘晶体中碘分子的配位数为12.
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρg•cm-3,其晶胞如图2所示,两个最近Ca2+核间距离为anm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$×10-21a3ρNA.
回答下列问题:
(1)溴原子的价层电子排布图为
 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
(3)ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-具有相同空间构型和键合形式的物质化学式为(写出一个即可)Cl2O、OF2等.
(4)如图1为碘晶体胞结构,平均每个晶胞中有8个碘原子,碘晶体中碘分子的配位数为12.
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρg•cm-3,其晶胞如图2所示,两个最近Ca2+核间距离为anm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$×10-21a3ρNA.

13.滴定操作时,通过滴定管滴加到试样溶液中的溶液是( )
| A. | 一般溶液 | B. | 待测溶液 | ||
| C. | 有一定浓度的溶液 | D. | 标准溶液 |
10.下列有关说法不正确的是( )
| A. | 酶是一种蛋白质 | B. | 蛋白质是有机高分子化合物 | ||
| C. | 蛋白质的基本组成单位为氨基酸 | D. | 氨基酸是羧酸,显酸性 |
17.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍.下列说法中正确的是( )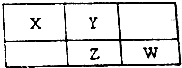

| A. | 原子半径Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W | |
| C. | 四种元素的单质中,Z单质的熔、沸点最高 | |
| D. | Z的单质与足量的单质Y反应,直接得到一种ZY3的物质 |
 镍和铜都是重要的有色金属材料,回答下列问题:
镍和铜都是重要的有色金属材料,回答下列问题: