题目内容
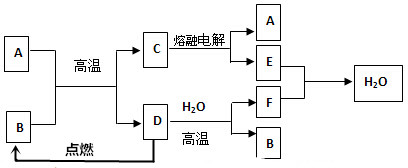
10.某课外活动小组为探究金属与浓硫酸反应,进行了如下实验.Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示.(固定装置已略去)

(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O;A装置铜丝如图设计的原因是增大铜与浓硫酸的接触面积,反应随时发生,随时停止.
(2)C中浓硫酸的作用是除去反应中产生的水蒸气.
(3)F烧杯中的溶液通常是NaOH溶液(或酸性KMnO4溶液等).
(4)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
(5)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
分析 (1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;铜丝完成螺旋状是为了增大与浓硫酸的接触面积增大反应速率,抽出后可以停止反应;
(2)C中浓硫酸是吸收气体中的水蒸气;
(3)二氧化硫有毒,多余的二氧化硫气体需要用氢氧化钠溶液或酸性高锰酸钾溶液吸收;
(4)根据C中氧化铜是否被还原及E中品红溶液是否褪色判断;
(5)反应后的混合液中含有浓硫酸,不能向冷却后的溶液中加水,否则会导致液体溅出,应该类比稀释浓硫酸的方法进行操作.
解答 解:Ⅰ.(1)碳和浓硫酸在加热条件下生成二氧化碳、二氧化硫和水,反应的化学方程式为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O,A装置铜丝如图设计的原因是增大铜与浓硫酸的接触面积,反应随时发生,随时停止,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O;增大铜与浓硫酸的接触面积,反应随时发生,随时停止;
(2)C中浓硫酸是吸收气体中的水蒸气,防止进入装置D炸裂试管,
故答案为:除去反应中产生的水蒸气;
(3)二氧化硫气体是一种有毒气体,剩余的二氧化硫气体不能直接排放,应该用NaOH溶液或酸性KMnO4溶液等吸收,
故答案为:NaOH溶液(或酸性KMnO4溶液等);
(4)由于D装置中黑色固体颜色无变化,E中溶液褪色,说明反应生成了二氧化硫,证明反应中S元素被还原,在反应中作氧化剂,而氢离子没有被还原,所以浓硫酸的中S的氧化性大于氢离子,
故答案为:D装置中黑色固体颜色无变化,E中溶液褪色;
(5)含有铜离子的溶液显示蓝色,需要将反应后的溶液用水稀释,由于反应后的溶液中含有浓硫酸,所以应该将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝,
故答案为:将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
点评 本题考查了浓硫酸的性质、常见气体检验的方法和操作顺序、对实验原理的理解等,题目难度中等,注意掌握浓硫酸的性质及常见气体的检验方法.

| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 | |
| C. | 原电池中发生的反应达平衡时,该电池仍有电流产生 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
| A. | 硒(Se)化氢比硫化氢稳定 | B. | 钫(Fr)与水反应比钾与水反应剧烈 | ||
| C. | 铍(Be)的原子失电子能力比镁弱 | D. | 氢氧化锶(Sr)比氢氧化钙的碱性强 |
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
(1)实验目的:研究同周期元素性质递变规律.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
(4)此实验的结论:同周期从左到右元素金属性减弱,非金属性增强(或金属性Na>Mg>Al,非金属性Cl>S).
| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
| A. | 向醋酸溶液中通入少量HCl(g),溶液中c(H+)/c(CH3COOH)增大 | |
| B. | pH=8的NaHS的溶液中,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | |
| C. | 0.1mol/L盐酸与0.1mol/L氨水等体积混合后的溶液中:c(OH-)>c(H+)+c(NH3•H2O) | |
| D. | 某CH3COONa溶液的pH=b,其中由水电离出的c(H+)=10b-14mol/L |
 .
.