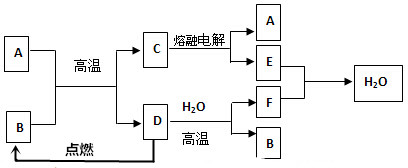
题目内容
8.某实验小组为测定某石灰石中CaCO3的质量分数,先称取W g石灰石样品,加入过量的浓度为6mol•L-1的盐酸,使样品完全溶解,加热煮沸后,除去溶解的CO2,再向溶液中加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀:C2O42-+Ca2+=CaC2O4↓,过滤出CaC2O4后,用稀H2SO4溶解:CaC2O4+H2SO4=H2C2O4+CaSO4,再用蒸馏水稀释溶液至V0 mL.取出V1 mL,用a mol•L-1的KMnO4酸性溶液进行滴定,此时发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,若滴定终点时消耗a mol•L-1的KMnO4溶液V2 mL,则样品中CaCO3的质量分数为( )| A. | $\frac{25a{V}_{0}{V}_{2}}{W{V}_{1}}$% | B. | $\frac{25a{V}_{1}{V}_{2}}{W{V}_{0}}$% | C. | $\frac{25a{V}_{1}{V}_{0}}{W{V}_{2}}$% | D. | $\frac{25a{V}_{2}}{W}$% |
分析 根据Ca原子、草酸根离子守恒得5CaCO3~5CaC2O4~5H2C2O4~2MnO4-,根据碳酸钙和高锰酸根离子之间的关系式计算.
解答 解:根据Ca原子、草酸根离子守恒得5CaCO3~5CaC2O4~5H2C2O4~2MnO4-,
设高锰酸钾溶液消耗的碳酸钙的物质的量为x,
5CaCO3~5CaC2O4~5H2C2O4~2MnO4-,
5 2
x (a×V2×10-3)mol
5:2=x:(a×V2×10-3)mol
x=$\frac{a×{V}_{2}×1{0}^{-3}×5}{2}$mol=2.5aV2×10-3mol
则V0mL溶液中n(CaCO3)=$\frac{2.5a{V}_{2}×1{0}^{-3}}{{V}_{1}×1{0}^{-3}}×{V}_{0}$×10-3mol=$\frac{2.5a{V}_{0}{V}_{2}×1{0}^{-3}}{{V}_{1}}$mol,
其质量分数=$\frac{\frac{2.5a{V}_{0}{V}_{2}×1{0}^{-3}}{{V}_{1}}×100}{W}×100%$=$\frac{25a{V}_{0}{V}_{2}}{W{V}_{1}}$%,
故选A.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析判断及计算能力,明确各个物理量之间的关系式是解本题关键,注意单位换算.

练习册系列答案
相关题目
18.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A. | 硒(Se)化氢比硫化氢稳定 | B. | 钫(Fr)与水反应比钾与水反应剧烈 | ||
| C. | 铍(Be)的原子失电子能力比镁弱 | D. | 氢氧化锶(Sr)比氢氧化钙的碱性强 |
19.室温下,下列溶液中粒子的物质的量浓度关系不正确的是( )
| A. | 向醋酸溶液中通入少量HCl(g),溶液中c(H+)/c(CH3COOH)增大 | |
| B. | pH=8的NaHS的溶液中,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | |
| C. | 0.1mol/L盐酸与0.1mol/L氨水等体积混合后的溶液中:c(OH-)>c(H+)+c(NH3•H2O) | |
| D. | 某CH3COONa溶液的pH=b,其中由水电离出的c(H+)=10b-14mol/L |
16.卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
回答下列问题:
(1)溴原子的价层电子排布图为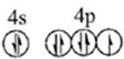 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合(HF)2形式存在,使氟化氢分子缔合的相互作用是氢键.碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:CsICl2$\frac{\underline{\;\;△\;\;}}{\;}$CsCl+ICl.
(3)ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-具有相同空间构型和键合形式的物质化学式为(写出一个即可)Cl2O、OF2等.
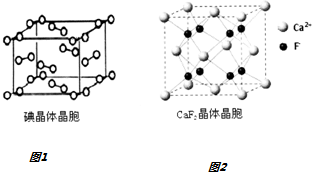
(4)如图1为碘晶体胞结构,平均每个晶胞中有8个碘原子,碘晶体中碘分子的配位数为12.
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρg•cm-3,其晶胞如图2所示,两个最近Ca2+核间距离为anm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$×10-21a3ρNA.
回答下列问题:
(1)溴原子的价层电子排布图为
 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
(3)ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-具有相同空间构型和键合形式的物质化学式为(写出一个即可)Cl2O、OF2等.
(4)如图1为碘晶体胞结构,平均每个晶胞中有8个碘原子,碘晶体中碘分子的配位数为12.
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρg•cm-3,其晶胞如图2所示,两个最近Ca2+核间距离为anm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$×10-21a3ρNA.

3.下列混合物无论总质量或总物质的量一定,完全燃烧生成二氧化碳、水的量都一定的是( )
| A. | 甲烷和甲醇 | B. | 丙醛和丙酮 | C. | 乙烯和乙炔 | D. | 乙烯和乙醇 |
13.滴定操作时,通过滴定管滴加到试样溶液中的溶液是( )
| A. | 一般溶液 | B. | 待测溶液 | ||
| C. | 有一定浓度的溶液 | D. | 标准溶液 |
17.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍.下列说法中正确的是( )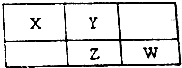

| A. | 原子半径Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W | |
| C. | 四种元素的单质中,Z单质的熔、沸点最高 | |
| D. | Z的单质与足量的单质Y反应,直接得到一种ZY3的物质 |
1.下列说法不正确的是( )
| A. | 室温下,NH4Cl溶液加水稀释过程中,$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$数值增大 | |
| B. | O.lOOOmol•L-1 的醋酸钠溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1000mol•L-1 | |
| C. | 室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,则Ka1(H2CO3)×Ka2(H2CO3)<K | |
| D. | 室温,Ka(CH3COOH)=l.76×l0-5,Kb(NH3•H2O)=1.76×lO-5.则CH3COONH4溶液中存在:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-)>c(NH3•H2O)=c(CH3COOH) |