题目内容
5.25℃,101k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:A(g)+2B(g)?2C(g)+2D(l)△H=-250kJ•mol-1 K=0.2L/mol
(1)写出该反应平衡常数的表达式:K=$\frac{{{c^2}(C)}}{{c(A)•{c^2}(B)}}$.
(2)该反应的逆反应的△H=﹢250kJ/mol,该反应的逆反应的K=5mol/L.
(3)对该反应而言,升高温度,平衡常数将减小;增大压强,平衡常数将不变.(填“增大”、“减小”或“不变”)
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积;
(2)正逆反应的焓变数值相同,符号相反;正逆反应的K互为倒数关系;
(3)该反应为放热反应,升高温度平衡逆向移动,K只与温度有关.
解答 解:(1)该反应平衡常数的表达式K=$\frac{{{c^2}(C)}}{{c(A)•{c^2}(B)}}$,故答案为:K=$\frac{{{c^2}(C)}}{{c(A)•{c^2}(B)}}$;
(2)正逆反应的焓变数值相同,符号相反,则该反应的逆反应的△H=﹢250kJ/mol;正逆反应的K互为倒数关系,则该反应的逆反应的K=$\frac{1}{0.2}$=5 mol/L,
故答案为:﹢250kJ/mol;5 mol/L;
(3)该反应为放热反应,升高温度平衡逆向移动,K只与温度有关,则升高温度,平衡常数将减小;增大压强,平衡常数将不变,
故答案为:减小;不变.
点评 本题考查化学平衡常数的意义,为高频考点,把握K的表达式及意义、影响因素为解答的关键,侧重分析与应用能力的考查,注意纯固体和液体不能代入K的表达式中,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
15.下列与化学概念有关的说法正确的是( )
| A. | Na2O、CaO、Al2O3均为碱性氧化物 | |
| B. | 液溴不导电,所以液溴是非电解质 | |
| C. | 12C与13C的核外电子排布方式相同,化学性质相同 | |
| D. | 只含共价键的物质一定是共价化合物 |
16.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温下,1 mol•L-1的NH4NO3溶液中含有氮原子的数目为2 NA | |
| B. | 22.4L氯气通入足量氢氧化钠溶液中充分反应,转移的电子数为NA | |
| C. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| D. | 4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1NA |
13.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A. | K+、H+、Fe2+、MnO4- | B. | Fe3+、Ba2+、SO42-、NO3- | ||
| C. | Al3+、Na+、SO42-、CO32- | D. | Fe3+、H+、SO42-、ClO- |
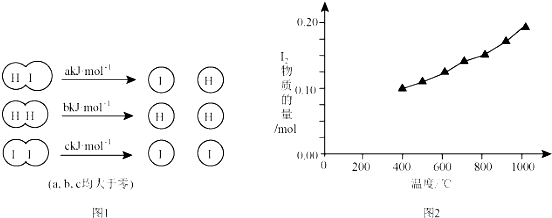
7.已知,反应①:I2(aq)+I-(aq)?I3-(aq)△H1;
反应②:I3-(aq)?I2(aq)+I-(aq)△H2;
反应①的化学平衡常数K1与温度的关系如表:
请回答:
(1)若反应②的化学平衡常数为K2,在相同温度下,K1•K2=1.
(2)上述反应①的△H1<0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会加快(填“加快”、“减慢”或“不变”).
(3)能判断反应①已达到平衡的依据是BC
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800.在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
反应速率最快的是丙(填“甲”、“乙”或“丙”),平衡时I2的转化率最大的是甲(填“甲”、“乙”或“丙”).
反应②:I3-(aq)?I2(aq)+I-(aq)△H2;
反应①的化学平衡常数K1与温度的关系如表:
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K1 | 1100 | 841 | 680 | 533 | 409 |
(1)若反应②的化学平衡常数为K2,在相同温度下,K1•K2=1.
(2)上述反应①的△H1<0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会加快(填“加快”、“减慢”或“不变”).
(3)能判断反应①已达到平衡的依据是BC
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800.在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
| 起始浓度(mol/L) | 甲 | 乙 | 丙 |
| c(I2) | 0.1 | 0.2 | 0.2 |
| c(I-) | 0.2 | 0.1 | 0.2 |
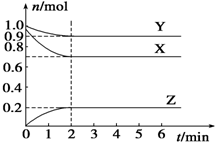 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: