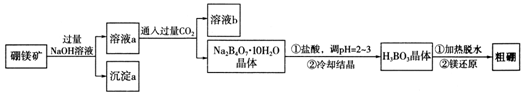
题目内容
15.下列与化学概念有关的说法正确的是( )| A. | Na2O、CaO、Al2O3均为碱性氧化物 | |
| B. | 液溴不导电,所以液溴是非电解质 | |
| C. | 12C与13C的核外电子排布方式相同,化学性质相同 | |
| D. | 只含共价键的物质一定是共价化合物 |
分析 A.氧化铝为两性氧化物;
B.非电解质必须是化合物;
C.同位素具有相同的核外电子排布,相同的化学性质;
D.氢气只含有共价键.
解答 解:A.Na2O、CaO为碱性氧化物,氧化铝为两性氧化物,故A错误;
B.液溴为单质,不是非电解质,故B错误;
C.12C与13C为同位素,同位素具有核外电子排布方式相同,化学性质相同,故C正确;
D.只含共价键的物质不一定是共价化合物,可能是单质,故D错误;
故选:C.
点评 本题考查了酸、碱、盐、氧化物、电解质、非电解质、碱性氧化物的判断,明确基本概念是解题关键,注意物质类型所含化学键关系,题目难度不大.

练习册系列答案
相关题目
5.苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下:
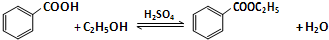
已知:
*苯甲酸在100℃会迅速升华.
(1)如图1为课本上制取乙酸乙酯的实验装置图,请回答下列问题:
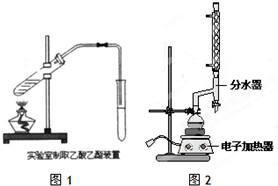
①乙醇、乙酸和浓硫酸混合的先后顺序先加乙醇,再加浓硫酸,等冷却再加乙酸;
②浓硫酸的作用是催化剂和吸水剂;
③实验开始前在饱和碳酸钠加入酚酞,溶液会变红,随着乙酸乙酯的蒸出,红色会变浅,但是无气体产生,请写出发生该变化的离子反应方程式CH3COOH+CO32-=CH3COO-+HCO3-;
(2)按照图2所示装置制备苯甲酸乙酯.
①制备:在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、4mL浓硫酸,混合均匀并加入沸石,按图2所示连接好仪器,其中分水器的作用是分离出反应生成的水,控制温度加热回流2h.
a.实验中使用分水器不断分离除去水的目的是分离反应过程中生的水,促进酯化反应向正反应方向进行;
b.从提供的分析实验室制取苯甲酸乙酯为什么不使用制取乙酸乙酯一样的装置?如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低;
②产品的提纯
将圆底烧瓶中的残液倒入盛有冷水的烧瓶中,分批加入Na2CO3溶液呈中性;用分液漏斗分出有机层得粗产品.水层用25mL乙醚萃取分液,醚层与粗产品合并;在粗产品加入无水氯化钙后,静置、过滤,过滤液进行蒸馏,蒸出乙醚后,继续升温,接收210~213℃的馏分;产品经检验合格,测得产品体积为6mL.
c.在该实验分液过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”可“下口倒出”);
d.该实验中苯甲酸乙酯的产率为42%;
e.若加入的Na2CO3溶液不足,在之后的蒸馏时烧瓶内会出现白烟生成,产生该现象的原因在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
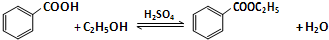
已知:
| 物质 | 颜色状态 | 密度/g/cm3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
(1)如图1为课本上制取乙酸乙酯的实验装置图,请回答下列问题:

①乙醇、乙酸和浓硫酸混合的先后顺序先加乙醇,再加浓硫酸,等冷却再加乙酸;
②浓硫酸的作用是催化剂和吸水剂;
③实验开始前在饱和碳酸钠加入酚酞,溶液会变红,随着乙酸乙酯的蒸出,红色会变浅,但是无气体产生,请写出发生该变化的离子反应方程式CH3COOH+CO32-=CH3COO-+HCO3-;
(2)按照图2所示装置制备苯甲酸乙酯.
①制备:在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、4mL浓硫酸,混合均匀并加入沸石,按图2所示连接好仪器,其中分水器的作用是分离出反应生成的水,控制温度加热回流2h.
a.实验中使用分水器不断分离除去水的目的是分离反应过程中生的水,促进酯化反应向正反应方向进行;
b.从提供的分析实验室制取苯甲酸乙酯为什么不使用制取乙酸乙酯一样的装置?如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低;
②产品的提纯
将圆底烧瓶中的残液倒入盛有冷水的烧瓶中,分批加入Na2CO3溶液呈中性;用分液漏斗分出有机层得粗产品.水层用25mL乙醚萃取分液,醚层与粗产品合并;在粗产品加入无水氯化钙后,静置、过滤,过滤液进行蒸馏,蒸出乙醚后,继续升温,接收210~213℃的馏分;产品经检验合格,测得产品体积为6mL.
c.在该实验分液过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”可“下口倒出”);
d.该实验中苯甲酸乙酯的产率为42%;
e.若加入的Na2CO3溶液不足,在之后的蒸馏时烧瓶内会出现白烟生成,产生该现象的原因在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
6.关于0.1mol/L Na2CO3溶液的叙述错误的是( )
| A. | 0.5 L该溶液中钠离子的物质的量浓度为0.1 mol/L | |
| B. | 1 L该溶液中含有Na2CO3的质量为10.6 g | |
| C. | 从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol/L | |
| D. | 取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol/L |
10.某有机物的结构简式如图所示,有关该有机物的叙述正确的是( )
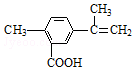

| A. | 在一定条件下,能发生取代、氧化、水解、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
20.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 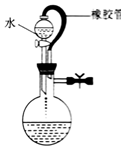 该装置气密性良好 | B. |  实验室制备氯气 | ||
| C. | 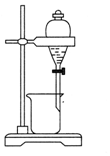 分离酒精和水 | D. | 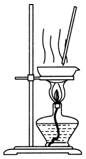 蒸干NH4Cl溶液制NH4Cl固体 |
4.下列关于溶液物质的量浓度的说法正确的是( )
| A. | 标准状况下,将22.4 L HC1溶于1L水,可配成1 mol•L-l的稀盐酸 | |
| B. | 将100 mL 18 mol•L-1的浓H2SO4和100 mL水混合,可配成9 moI•L-l的H2SO4溶液 | |
| C. | 将4.0 g NaOH溶于100 mL容量瓶中,加水至刻度线,配成1 mol•L-1的NaOH溶液 | |
| D. | 将0.1 mol NaCl配成100 mL溶液,从中取出10 mL,所取出溶液的物质的量浓度为1 mol•L-l |