题目内容
3.单质碘的提取及应用中有关的转化关系如图所示.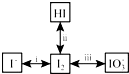
(1)可利用i 中反应从海带灰浸取液中提取单质碘,若所用试剂为双氧水、稀硫酸,其离子方程式是H2O2+2I-+2H+=I2+2H2O.
(2)ii三种分子化学键断裂时能量变化如图1 所示.其他条件相同,1mol HI 在不同温度分解达平衡时,测得体系中I2物质的量随温度变化的曲线如图2 所示.
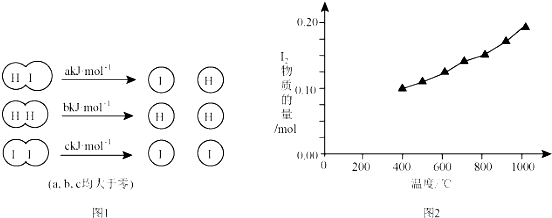
①比较2a>b+c(填“<<”、“>>”或“=”),理由是根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g)?H2(g)+I2(g),△H>0,△H=2a-(b+c)>0,所以2a>b+c.
②某温度下该反应平衡常数为$\frac{1}{64}$,达平衡时,1mol HI 分解的转化率为20%.
③若利用此反应制备I2,则能提高HI 转化率的措施是ac(填字母序号).
a.移走I2 b.加压 c.升温 d.增大HI 浓度
(3)iii 中,碱性条件下I2可以转化为IO3-.电解KI 溶液制备 KIO3的工作原理如图3所示.
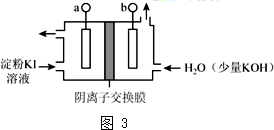
电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅.
①a 连接电源的正极.
②结合实验现象和电极反应式说明制备KIO3的原理:I-在阳极失电子生成I2,使阳极溶液变蓝色,OH-通过阴离子交换膜移向阳极,在阳极室I2与OH-反应2I2+6OH-=5I-+IO3-+3H2O,使阳极区域蓝色变浅.
分析 (1)双氧水具有氧化性、碘离子具有还原性,酸性条件下,双氧水和碘离子发生氧化还原反应生成碘和水;
(2)①根据图2知,升高温度碘含量增大,说明HI的分解反应是吸热反应,则2molHI分解吸收的能量大于1mol碘和1mol氢气分解吸收的能量;
②化学平衡常数K=$\frac{c({I}_{2}).c({H}_{2})}{{c}^{2}(HI)}$;
③能提高HI 转化率的措施降低生成物浓度、升高温度;
(3)根据图知,发现a极变蓝,则a电极上碘离子转化为碘,a为阳极,b为阴极;
①连接电源正极的为阳极;
②.碱性条件下碘被氧化生成碘酸根离子.
解答 解:(1)双氧水具有氧化性、碘离子具有还原性,酸性条件下,双氧水和碘离子发生氧化还原反应生成碘和水,离子方程式为H2O2+2I-+2H+=I2+2H2O,
故答案为:H2O2+2I-+2H+=I2+2H2O;
(2)①根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g)?H2(g)+I2(g),△H>0,△H=2a-(b+c)>0,所以2a>b+c,
故答案为:>;根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g)?H2(g)+I2(g),△H>0,△H=2a-(b+c)>0,所以2a>b+c;
②化学平衡常数K=$\frac{c({I}_{2}).c({H}_{2})}{{c}^{2}(HI)}$,因碘和氢气的计量数相等,则K=$\frac{c({I}_{2}).c({H}_{2})}{{c}^{2}(HI)}$=$\frac{{c}^{2}({H}_{2})}{{c}^{2}(HI)}$=$\frac{1}{64}$,所以$\frac{c({H}_{2})}{c(HI)}$=$\frac{1}{8}$,设平衡时氢气浓度是xmol/L、HI浓度是8xmol/L,生成的碘是参加反应的HI的2倍,则参加反应的HI浓度是2xmol/L,所以HI转化率=$\frac{2xmol/L}{(2x+8x)mol/L}$×100%=20%,
故答案为:20%;
③a.移走I2,平衡正向移动,则提高HI转化率,故正确;
b.该反应前后气体计量数之和不变,所以加压平衡不移动,不能提高HI转化率,故错误;
c.该反应的正反应是吸热反应,升温平衡正向移动,HI转化率提高,故正确;
d.增大HI 浓度平衡正向移动,但HI浓度增大量远远大于HI转化浓度,所以HI转化率降低,故错误;
故选ac;
(3)根据图知,发现a极变蓝,则a电极上碘离子转化为碘,a为阳极,b为阴极;
①连接电源正极的为阳极,所以a连接电源正极,故答案为:正;
②I-在阳极失电子生成I2,使阳极溶液变蓝色,OH-通过阴离子交换膜移向阳极,在阳极室I2与OH-反应2I2+6OH-=5I-+IO3-+3H2O,使阳极区域蓝色变浅,
故答案为:I-在阳极失电子生成I2,使阳极溶液变蓝色,OH-通过阴离子交换膜移向阳极,在阳极室I2与OH-反应2I2+6OH-=5I-+IO3-+3H2O,使阳极区域蓝色变浅.
点评 本题考查较综合,涉及化学平衡计算、电解原理、反应热的计算等知识点,侧重考查学生分析判断、获取信息解答问题及计算能力,注意(2)③中d选项,很多同学往往认为“增大反应物浓度平衡正向移动则一定增大其转化率”而导致错误,为易错点.

| A. | 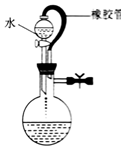 该装置气密性良好 | B. |  实验室制备氯气 | ||
| C. | 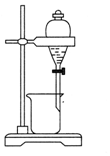 分离酒精和水 | D. | 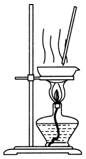 蒸干NH4Cl溶液制NH4Cl固体 |
| A. | 6.72 L CO | B. | 6.6 g CO2 | C. | 24 g SO3 | D. | 9.8 g H2SO4 |
| A. | 所含质子数为(A-n) | B. | 所含中子数为Z | ||
| C. | 所含电子数为(Z+n) | D. | 中子数-电子数=A-2Z+n |
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
| 物质名称 | 红磷与白磷 | 庚烷与十六烷 | 氯仿与三氯甲烷 | 氕与氘、氚 | 新戊烷与2,2-二甲基丁烷 | 2-甲基戊烷与2,3-二甲基丁烷 |
| 相互关系 |
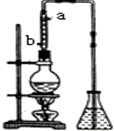 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$n(C2H4O)