题目内容
2.药物E具有抗癌抑菌功效,其合成路线如图.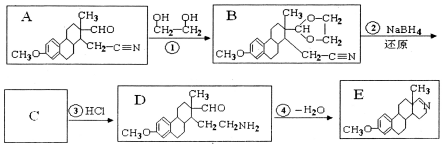
己知:NaBH4是一种很强的还原剂,可以将-C≡N还原为-CH2NH2
(1)化合物A的含氧官能团名称为醛基、醚键.
(2)反应①实际经历了两步反应,这两步的反应类型依次为加成反应、取代反应.设计反应①的目的是保护醛基.
(3)关于化合物D的说法错误的是ad(填序号).
a.1molD最多可与3molH2发生加成反应 b.可以与盐酸发生反应
c.可以使高锰酸钾酸性溶液褪色 d.是一种芳香烃
(4)反应物
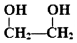 的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式
的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式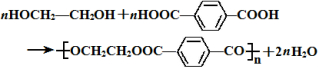 ;
;(5)以CH3CHO和CH3NH2为原料设计合成丙氨酸(CH3CH(NH2)COOH)的路线.
己知:RCH=NR′$\stackrel{HCN}{→}$
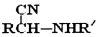 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$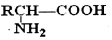
提示:①合成过程中无机试剂任选.
②合成路线表示方法示例为:CH3CH2Br$→_{△}^{NaOH、H_{2}O}$CH3CH2OH→…
分析 (1)根据有机物的结构简式判断官能团;
(2)反应①涉及-CHO的加成,并形成C-O-键,可饱和醛基不被氧化;
(3)根据D的结构简式,其含有苯环、醛基、氨基来判断;
(4)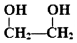 为乙二醇;对苯二甲酸发生缩聚反应生成高聚物;
为乙二醇;对苯二甲酸发生缩聚反应生成高聚物;
(5)CH3CHO和CH3NH2反应生CH3CH=NCH3,然后与HCN发生加成反应生成CH3C(CN)-NHCH3,然后在酸性条件下可生成目标物,以此解答该题.
解答 解:(1)由结构简式可知A含有醛基、醚键,故答案为:醛基、醚键;
(2)反应①涉及-CHO的加成,并形成C-O-键,同时发生取代反应,醛基在有机合成中易被氧化和还原,故应先保护,而后释放出来,防止被氧化,
故答案为:加成反应;取代反应;保护醛基;
(3)a.因为含有苯环、醛基,所以1mol D最多可与4mol H2发生加成反应,故a错误;
b.含有氨基,可以与盐酸发生反应,故b正确;
c.含有醛基,可被高锰酸钾氧化,可以使高锰酸钾酸性溶液褪色,故c正确;
d.含有O、N等元素,为烃的衍生物,故d错误.
故选ad;
(4)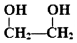 为乙二醇;对苯二甲酸发生缩聚反应生成高聚物,方程式为
为乙二醇;对苯二甲酸发生缩聚反应生成高聚物,方程式为 ,
,
故答案为:乙二醇; ;
;
(5)CH3CHO和CH3NH2反应生CH3CH=NCH3,然后与HCN发生加成反应生成CH3C(CN)-NHCH3,然后在酸性条件下可生成目标物,反应流程为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,侧重考查学生的分析能力,题目难度中等,解答本题的关键是根据官能团的结构、性质以及物质之间反应的官能团的转化判断可能发生的反应类型,准确把握题给信息.

练习册系列答案
相关题目
2.分子式为C3H5Cl,考虑顺反异构,且可以使溴的四氯化碳溶液褪色的结构可能是( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
3.锌是一种应用广泛的金属.某工厂用下图工艺冶炼锌,其中锌焙砂主要含ZnO、ZnFe2O4及少量FeO、CuO等氧化物.

金属阳离子在常温下以氢氧化物的形式沉淀时溶液的pH见表:
回答下列问题:
(1)为了加快锌矿石培烧的速率,可采取的措施有将锌矿石粉碎成细颗粒(回答一点即可).
(2)试剂A是-种由两种元素组成的液态“绿色”氧化剂,则加入试剂A后发生反应的离子方程式为2Fe2++2H++H2O2=2 Fe3++2H2O;试剂B最好选用ZnO或ZnCO3或Zn(OH)2,pH的调控范围为3.7≤pH<4.4.
(3)试剂C是Zn;电解产物中有一种物质可循环使用,该物质是H2SO4.
(4)酸浸时,ZnFe2O4会生成两种盐,该反应的化学方程式为ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O.
(5)沉积物中除生成的沉淀外还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因可能是Fe(OH)3胶体(沉淀)具有吸附性.
(6)若0.1t锌焙砂通过上述流程处理后最终得到了21.4kg沉淀物,则锌焙砂中铁元素的质量分数最大为11.2%.

金属阳离子在常温下以氢氧化物的形式沉淀时溶液的pH见表:
| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 6.6 | 5.2 | 4.4 |
| 沉淀完全时的pH | 3.7 | 8.9 | 8.1 | 5.7 |
(1)为了加快锌矿石培烧的速率,可采取的措施有将锌矿石粉碎成细颗粒(回答一点即可).
(2)试剂A是-种由两种元素组成的液态“绿色”氧化剂,则加入试剂A后发生反应的离子方程式为2Fe2++2H++H2O2=2 Fe3++2H2O;试剂B最好选用ZnO或ZnCO3或Zn(OH)2,pH的调控范围为3.7≤pH<4.4.
(3)试剂C是Zn;电解产物中有一种物质可循环使用,该物质是H2SO4.
(4)酸浸时,ZnFe2O4会生成两种盐,该反应的化学方程式为ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O.
(5)沉积物中除生成的沉淀外还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因可能是Fe(OH)3胶体(沉淀)具有吸附性.
(6)若0.1t锌焙砂通过上述流程处理后最终得到了21.4kg沉淀物,则锌焙砂中铁元素的质量分数最大为11.2%.
17.维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸.在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右.十二中某研究性学习小组测定了某品牌软包装橙汁中维生素C的含量,下面是他们的实验分析报告.
(一)测定目的:测定×××牌软包装橙汁中维生素C的含量.
(二)测定原理:C6H8O6+I2→C6H6O6+2H++2I-
(三)实验用品及试剂
(1)仪器和用品(自选,略)
(2)试剂:指示剂淀粉溶液(填名称),浓度为8.00×10-3mol•L-1的I2标准溶液、蒸馏水等.
(四)实验过程
(3)洗涤仪器,检查滴定管是否漏液,润洗相关仪器后,装好标准碘溶液待用.
(4)用酸式滴定管(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂.
(5)用左手控制滴定管的活塞(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到滴定终点.滴定至终点时的现象是最后一滴标准液滴入时,溶液由无色变为蓝色,且半分钟内不褪色.
(五)数据记录与处理
(6)若经数据处理,则此橙汁中维生素C的含量是1056.00mg/L.
(六)问题讨论
(7)从分析数据看,此软包装橙汁是否是纯天然橙汁?不是(填“是”或“不是”或“可能是”,1分).生产商最可能采取的做法是B(填编号):
A.加水稀释天然橙汁 B.将维生素C作为添加剂 C.橙汁已被浓缩.
(一)测定目的:测定×××牌软包装橙汁中维生素C的含量.
(二)测定原理:C6H8O6+I2→C6H6O6+2H++2I-
(三)实验用品及试剂
(1)仪器和用品(自选,略)
(2)试剂:指示剂淀粉溶液(填名称),浓度为8.00×10-3mol•L-1的I2标准溶液、蒸馏水等.
(四)实验过程
(3)洗涤仪器,检查滴定管是否漏液,润洗相关仪器后,装好标准碘溶液待用.
(4)用酸式滴定管(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂.
(5)用左手控制滴定管的活塞(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到滴定终点.滴定至终点时的现象是最后一滴标准液滴入时,溶液由无色变为蓝色,且半分钟内不褪色.
(五)数据记录与处理
| 起始(mL) | 终点(mL) | |
| 1 | 5.00 | 20.02 |
| 2 | 3.00 | 18.00 |
| 3 | 4.00 | 18.98 |
(六)问题讨论
(7)从分析数据看,此软包装橙汁是否是纯天然橙汁?不是(填“是”或“不是”或“可能是”,1分).生产商最可能采取的做法是B(填编号):
A.加水稀释天然橙汁 B.将维生素C作为添加剂 C.橙汁已被浓缩.

 .
. ,写出由该物质制备D的一种常见单质的反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;
,写出由该物质制备D的一种常见单质的反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;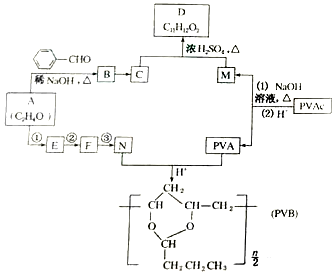
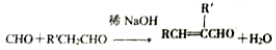 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)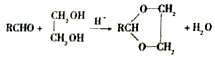
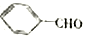 合成B的化学方程式是
合成B的化学方程式是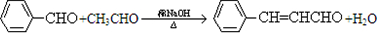 .
.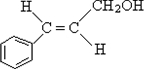 .
.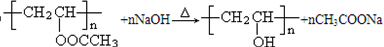 .
.
 将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示: