题目内容
14.已知CuS和Cu2S均为黑色,常温下都不溶于稀盐酸,在氧气中加热,最后都转化为CuO和SO2.某黑色固体样品的成分可能是CuO、CuS和Cu2S的一种或几种.某课外研究小组为探究其成分,设计以下实验测定该样品与氧气反应前后的质量变化,同时检测其气体产物.
(1)获得氧气的反应方程式为2H2O2 $\frac{\underline{\;CuCl_{2}\;}}{\;}$2H2O+O2↑.硫化亚铜与氧气反应的方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.
(2)利用上述装置(可重复使用)进行实验,气流经导管的顺序为eabfghIedab.
(3)实验测得样品质量为m1,与氧气充分反应后的固体质量为m2,m1=m2,且C装置中品红褪色,则样品的成分(写出所有可能情况)只含有Cu2S或含有CuO和Cu2S.
(4)该实验小组为了控制实验中氧气的产生速率,设计了如图1所示的实验装置继续探究不同的催化剂对H2O2分解的催化效率.
①实验时可以通过测量相同时间内产生O2的体积(或生成相同体积O2所需要的时间)来体现H2O2的分解速率的大小.
②请设计实验比较Fe3+含 Cu2+对H2O2分解的催化效率(完成以下实验方案):分别在锥形瓶中加入等浓度等体积的FeCl3溶液和CuCl2溶液,用针筒a分别装好等浓度等体积的H2O2溶液.氨上图密封好装置,将H2O2溶液快速注射进锥形瓶,并记录等时间内b这生成氧气的体积,最后,比较两个实验的氧气的体积.(试剂仪器不限,装置用图2)
分析 (1)装置B是过氧化氢滴入氯化铜溶液中,氯化铜做催化剂过氧化氢分解生成氧气;硫化亚铜与氧气反应生成氧化铜和二氧化硫;
(2)某黑色固体样品的成分可能是CuO、CuS和Cu2S的一种或几种,实验测定该样品与氧气反应前后的质量变化,同时检测其气体产物,通过装置c检验生成的二氧化硫气体,通过碱石灰吸收二氧化硫和水蒸气,并干燥氧气,进入装置D和样品发生反应,生成的二氧化硫易溶于水,通过装置E防止倒吸,通过装置C检验生成的二氧化硫,通过装置装置A吸收剩余的二氧化硫;
(3)实验测定样品质量为m1,与氧气充分反应后的固体质量为m2,m1=m2,且C装置中品红褪色,说明生成了二氧化硫气体,CuS和Cu2S至少有一种,因为反应后固体质量不变,结合反应Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 ,反应前后质量不变分析判断;
(4)①过氧化氢分解生成气体,测定生成气体的时间可以判断反应速率;
②比较Fe3+含 Cu2+对H2O2分解的催化效率,需要保持其他条件相同.
解答 解:(1)装置B是过氧化氢滴入氯化铜溶液中,氯化铜做催化剂过氧化氢分解生成氧气,反应的化学方程式为:2H2O2 $\frac{\underline{\;CuCl_{2}\;}}{\;}$2H2O+O2↑,硫化亚铜与氧气反应生成氧化铜和二氧化硫,反应的化学方程式为:Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2,
故答案为:2H2O2 $\frac{\underline{\;CuCl_{2}\;}}{\;}$2H2O+O2↑; Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 ,
(2)生成氧气需要干燥,二氧化硫可以用品红溶液检验,由于二氧化硫易溶于水需要防止倒吸且进行尾气吸收,气体产物,通过装置c检验生成的二氧化硫气体,通过碱石灰吸收二氧化硫和水蒸气,并干燥氧气,进入装置D和样品发生反应,生成的二氧化硫易溶于水,通过装置E防止倒吸,通过装置C检验生成的二氧化硫,通过装置装置A吸收剩余的二氧化硫,所以气流经导管的顺序为:eabfghiedab,
故答案为:eabfghiedab;
(3)实验测定样品质量为m1,与氧气充分反应后的固体质量为m2,m1=m2,且C装置中品红褪色,说明生成了二氧化硫气体,CuS和Cu2S至少有一种,因为反应后固体质量不变,结合反应Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 ,可知,反应前后固体质量不变,则样品中成分为Cu2S或CuO和Cu2S,
故答案为:只含有Cu2S或含有CuO和Cu2S;
(4)①过氧化氢分解生成氧气,实验过程中可以通过测定相同时间内生成氧气的体积或生成相同体积的氧气所需时间来表现过氧化氢的分解速率大小,
故答案为:相同时间内产生O2的体积或生成相同体积O2所需要的时间;
②比较Fe3+含 Cu2+对H2O2分解的催化效率,需要保持其他条件相同,实验方案为:分别在锥形瓶中加入等浓度等体积的FeCl3溶液和CuCl2溶液,用针筒a分别装好等浓度等体积的H2O2溶液,按照上图密封好装置,将H2O2溶液快速注射进锥形瓶,并记录等时间内b这生成氧气的体积,
故答案为:分别在锥形瓶中加入等浓度等体积的FeCl3溶液和CuCl2溶液,用针筒a分别装好等浓度等体积的H2O2溶液,按照上图密封好装置,将H2O2溶液快速注射进锥形瓶,并记录等时间内b这生成氧气的体积.
点评 本题考查了实验探究物质组成、反应现象判断、实验方案的设计、对比实验的应用等,掌握基础是解题关键,题目难度较大.

 期末集结号系列答案
期末集结号系列答案| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,其逆反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为:2.
表所列数据是该反应在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A(填序号):
A.正向移动 B.逆向移动 C.处于平衡状态 D.无法判断
(3)下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;再充入CO2气体,则平衡正向移动(选“正向移动”、“逆向移动”或“不移动”),平衡常数K不变(选“增大”、“减小”或“不变”).
(2)该反应的逆反应方向为放热反应方向(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下的各物质平衡浓度符合:c(CO2)=c(CO),c(H2)=c(H2O),试判断此时的温度为830℃.

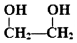 的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式
的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式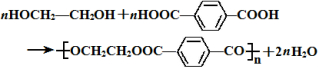 ;
;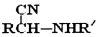 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$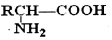

 中①、②、③三个-OH与钠反应活性由强到弱的顺序是③>①>②.
中①、②、③三个-OH与钠反应活性由强到弱的顺序是③>①>②. ,1molF在一定条件下与足量NaOH溶液反应,做多消耗NaOH的物质的量为3 mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:
,1molF在一定条件下与足量NaOH溶液反应,做多消耗NaOH的物质的量为3 mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式: .
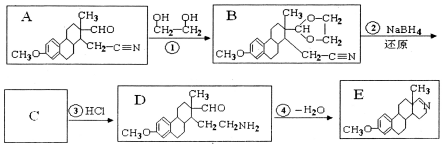
. 下列流程是A的一种合成方法,写出方框中各物质的结构简式:
下列流程是A的一种合成方法,写出方框中各物质的结构简式:
 化学反应原理在科研和工农业生产中有广泛应用.
化学反应原理在科研和工农业生产中有广泛应用.