��Ŀ����
11�� ��1mol I2��g�� ��2mol H2����2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g����H��0������ƽ�⣮HI���������w��HI����ʱ��仯��ͼ���ߣ�����ʾ��
��1mol I2��g�� ��2mol H2����2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g����H��0������ƽ�⣮HI���������w��HI����ʱ��仯��ͼ���ߣ�����ʾ����1����ƽ��ʱ��I2��g�������ʵ���Ũ��Ϊ0.05mol/L��
��2�����ı䷴Ӧ�������ڼ�������w��HI���ı仯�����ߣ��� ��ʾ������������w��HI���ı仯�����ߣ��� ��ʾ��������������Ǣۢݣ��������������Ǣܣ�������������������ţ�
�ٺ��������£������¶ȣ��ں��������£������¶ȣ��ۺ��������£���С��Ӧ����������ܺ��������£�����Ӧ����������ݺ��º��������£�������������
��3���������¶Ȳ��䣬����һ����ͬ��2L�ܱ������м���2mol I2��g����4mol H2��g��������Ӧ����ƽ��ʱ��HI����������ǵ���0.6������ڡ����ڡ�С�ڣ���
���� ��1����ƽ��ʱ��HI���������Ϊ60%������I2��g��+H2��g��?2HI��g����Ӧǰ��������䣬������n��HI��=3mol��60%=1.8mol���Դ˼���I2��g�������ʵ���Ũ�ȣ�
��2�����ߣ������ߣ��� Ϊ��ͬƽ��״̬�����¶���ͬ�����ߵ�ѹǿ��������ͬ�������ߣ��� ��Ӧ�Ͽ죻
��3���������¶Ȳ��䣬����һ����ͬ��2L�ܱ������м���2mol I2��g����4mol H2��g��������Ӧ���൱������ѹǿ��ƽ�ⲻ�ƶ���
��� �⣺��1����ƽ��ʱ��HI���������Ϊ60%������I2��g��+H2��g��?2HI��g����Ӧǰ��������䣬������n��HI��=3mol��60%=1.8mol���ɷ���ʽ��֪����0.9molI2��g�������ƽ��ʱ��I2��g�������ʵ���Ũ��Ϊ$\frac{1mol-0.9mol}{2L}$=0.05mol/L��
�ʴ�Ϊ��0.05��
��2�����ߣ������ߣ��� Ϊ��ͬƽ��״̬�������ߣ��� ��Ӧ�Ͽ죬ӦΪ�����������������������ߣ��� ӦΪ�����������Сѹǿ�����仯�¶ȣ�ƽ�ⷢ���ƶ��������ܴﵽ��ͬƽ��״̬��
�ʴ�Ϊ���ۢݣ��ܣ�
��3���������¶Ȳ��䣬����һ����ͬ��2L�ܱ������м���2mol I2��g����4mol H2��g��������Ӧ���൱������ѹǿ��ƽ�ⲻ�ƶ���HI�����������0.6���ʴ�Ϊ�����ڣ�
���� ���⿼����������Ի�ѧƽ���Ӱ�죬��Чƽ���֪ʶ�㣬Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע���������ķ�Ӧ�ص㼰��Чƽ���Ӧ�ã�

�����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
��2��300��ʱ����2molCO��3molH2��2molCH3OH�����ݻ�Ϊ1L���ܱ������У���ʱ��Ӧ��A������ţ���
A�������ƶ� B�������ƶ� C������ƽ��״̬ D�����ж�
��3��������˵��������Ӧ�ﵽ��ѧƽ��״̬�ı�־��C
A�����º����£����������ܶȲ��ڱ仯
B����ƽ��ʱ��v��CO����v��H2����v��CH3OH��=1��2��1
C����ƽ��ʱ��CH3OHŨ�Ȳ��ٱ仯
D����λʱ��������nmolCOͬʱ����2nmolH2��
| A | B | C | D | E | F | G | H | I | J | |
| ԭ�Ӱ뾶 ��10-10m�� | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| ������ ���ϼ� | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
��1��D��Ԫ�����ڱ��е�λ�õ������ڵ�VA�壬��H��һ��ͬλ��������Ϊ5������ԭ�ӷ�����510B��BԪ�ص�ԭ�ӽṹʾ��ͼ��
 ��G��F�ֱ��γɵļ����Ӱ뾶��С��ϵΪN3-��Na+��
��G��F�ֱ��γɵļ����Ӱ뾶��С��ϵΪN3-��Na+����2��F��A�γɵĻ��������ʽ�ǣ�
 ��
�� ��
����3���õ���ʽ��ʾF2I���γɹ��̣�
 ��
����4��F��J�γɵĻ��������ʽΪ
 ���û�������ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪNaH+H2O=NaOH+H2������
���û�������ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪNaH+H2O=NaOH+H2������ | A�� | C5H12��l��+8O2��g���T5CO2��g��+6H2O��l����H=-3 540 kJ•mol-1 | |
| B�� | C5H12��l��+8O2��g���T5CO2��g��+6H2O��g����H=-3 540 kJ•mol-1 | |
| C�� | C5H12��l��+8O2��g���T5CO2��g��+6H2O��g����H=+3 540 kJ•mol-1 | |
| D�� | C5H12��l��+8O2��g���T5CO2��g��+6H2O��l����H=+3 540 kJ•mol-1 |
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=$\frac{c��CO��•c��{H}_{2}O��}{c��C{O}_{2}��•c��{H}_{2}��}$���ٳ���CO2���壬��ƽ�������ƶ���ѡ�������ƶ������������ƶ������ƶ�������ƽ�ⳣ��K���䣨ѡ����������С�����䡱����
��2���÷�Ӧ���淴Ӧ����Ϊ���ȷ�Ӧ����ѡ�����ȡ����ȣ���
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������bc����ѡ�۷֣���
a��������ѹǿ���� b�����������c��CO������
c��v����H2��=v����H2O�� d��c��CO2��=c��CO��
��4��ij�¶��µĸ�����ƽ��Ũ�ȷ��ϣ�c��CO2��=c��CO����c��H2��=c��H2O�������жϴ�ʱ���¶�Ϊ830�森
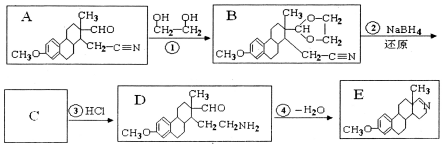
 ������Ϊ�Ҷ�����д������Ա������ᷴӦ���ɸ߾���Ļ�ѧ����ʽ
������Ϊ�Ҷ�����д������Ա������ᷴӦ���ɸ߾���Ļ�ѧ����ʽ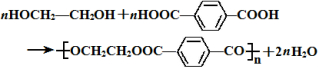 ��
��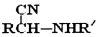 $\stackrel{H+}{��}$
$\stackrel{H+}{��}$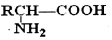
 ����Ϊ��ȩ���Ϸ�Ӧ��
����Ϊ��ȩ���Ϸ�Ӧ��
 ��
�� ��
�� ��
�� ��
��