题目内容
( I)某学生用胆矾制取氧化铜,并研究氧化铜能否在氯酸钾实验中起催化作用.装置如图,实验步骤如下: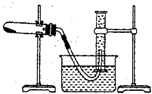
①称量a g胆矾固体放入烧杯中,加水溶解,向其中滴加氢氧化钠溶液至沉淀完全;②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;③过滤、洗涤、干燥,称量所得固体质量为b g;④称取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气.请回答下列问题:
(1)上述各步骤操作中,需要用到玻璃棒的是 (填写前面所述实验步骤的序号).
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①一④后还应该进行的实验操作是 (按实验先后顺序填写字母序号).
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用.你认为还应该进行的另一个实验是 .
(II).实验室需要200mL1mol?L-1的CuSO4溶液,
(1)下列有关配制该溶液的叙述正确的是
A.称取32g无水硫酸铜,加入200mL水,在250mL的容量瓶中配成溶液
B.称取50gCuSO4?5H2O,在250mL的容量瓶中配成200mL溶液
C.称取40g无水硫酸铜,加入250mL水,在250mL的容量瓶中配成250mL溶液
D.称取62.5gCuSO4?5H2O,在250mL的容量瓶中配成250mL溶液
(2)请将下列各操作,按正确的序号填在横线上.
A.溶解 B.用胶头滴管滴加水至刻度线 C.洗涤所用仪器2~3次,并将洗涤液转移到容量瓶中 D.称量 E.反复颠倒摇匀 F.将溶液转移到容量瓶中
其操作正确的顺序依次为 .
(3)选用的主要仪器有:①托盘天平,②药匙,③烧杯,④ ⑤ ⑥ .
(4)回答下列问题
①在转入容量瓶前烧杯中液体应冷却至室温,否则会使浓度 (填“偏高”偏低”
“无影响”,下同);
②洗涤液转入容量瓶后要振荡,若不振荡会使浓度 ;
③定容时必须使溶液凹液面与刻度线相平,若仰视会使浓度 ;
④用胶头滴管向容量瓶中加水时,不慎超过刻度线,用胶头滴管从瓶中吸出部分溶液使剩余溶液刚好达刻度线,会使浓度 ;
⑤使用洁净的容量瓶前,瓶中残留有少量蒸馏水,会使浓度 .

①称量a g胆矾固体放入烧杯中,加水溶解,向其中滴加氢氧化钠溶液至沉淀完全;②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;③过滤、洗涤、干燥,称量所得固体质量为b g;④称取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气.请回答下列问题:
(1)上述各步骤操作中,需要用到玻璃棒的是
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①一④后还应该进行的实验操作是
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用.你认为还应该进行的另一个实验是
(II).实验室需要200mL1mol?L-1的CuSO4溶液,
(1)下列有关配制该溶液的叙述正确的是
A.称取32g无水硫酸铜,加入200mL水,在250mL的容量瓶中配成溶液
B.称取50gCuSO4?5H2O,在250mL的容量瓶中配成200mL溶液
C.称取40g无水硫酸铜,加入250mL水,在250mL的容量瓶中配成250mL溶液
D.称取62.5gCuSO4?5H2O,在250mL的容量瓶中配成250mL溶液
(2)请将下列各操作,按正确的序号填在横线上.
A.溶解 B.用胶头滴管滴加水至刻度线 C.洗涤所用仪器2~3次,并将洗涤液转移到容量瓶中 D.称量 E.反复颠倒摇匀 F.将溶液转移到容量瓶中
其操作正确的顺序依次为
(3)选用的主要仪器有:①托盘天平,②药匙,③烧杯,④
(4)回答下列问题
①在转入容量瓶前烧杯中液体应冷却至室温,否则会使浓度
“无影响”,下同);
②洗涤液转入容量瓶后要振荡,若不振荡会使浓度
③定容时必须使溶液凹液面与刻度线相平,若仰视会使浓度
④用胶头滴管向容量瓶中加水时,不慎超过刻度线,用胶头滴管从瓶中吸出部分溶液使剩余溶液刚好达刻度线,会使浓度
⑤使用洁净的容量瓶前,瓶中残留有少量蒸馏水,会使浓度
考点:性质实验方案的设计,配制一定物质的量浓度的溶液
专题:实验题,实验设计题
分析:(I)(1)胆矾固体放入烧杯中,加水制成溶液时需要用玻璃棒搅拌,加速胆矾固体溶解速度;在蒸发时用玻璃棒搅拌,是为了防止局部温度过高使液滴飞溅;过滤时用到玻璃棒的作用是引流;氧化铜固体和一定质量的氯酸钾固体,混合均匀也需要玻璃棒的搅拌;
(2)ag胆矾中含铜元素质量为ag×
=
a,设能制得氧化铜的质量为X,根据铜守恒由X×
═
a解得X=
a,所以由胆矾制备氧化铜的产率:
×100%=
;
(3)由于需要证明反应前后氧化铜的质量不变,反应后先将氧化铜从混合物中分离出来:加水溶解,进行过滤,得到的氧化铜上有氯化钾溶液,进行洗涤干燥,再进行称量即可;
(4)通过对比实验才能说明氧化铜的确加快了氯酸钾的反应速度,另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢,现象很明显.
(II)(1)根据n=c×V计算溶质的物质的量,配制硫酸铜溶液可以用硫酸铜,也可以用胆矾,根据m=n×M计算各自质量,配制溶液时注意水的体积不等于溶液的体积;
(2)根据实验步骤进行分析;
(3)根据实验步骤选择仪器;
(4)根据C=
判断浓度的变化.
(2)ag胆矾中含铜元素质量为ag×
| 64 |
| 250 |
| 32 |
| 125 |
| 64 |
| 80 |
| 32 |
| 125 |
| 8 |
| 25 |
| b | ||
|
| 25b |
| 8a |
(3)由于需要证明反应前后氧化铜的质量不变,反应后先将氧化铜从混合物中分离出来:加水溶解,进行过滤,得到的氧化铜上有氯化钾溶液,进行洗涤干燥,再进行称量即可;
(4)通过对比实验才能说明氧化铜的确加快了氯酸钾的反应速度,另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢,现象很明显.
(II)(1)根据n=c×V计算溶质的物质的量,配制硫酸铜溶液可以用硫酸铜,也可以用胆矾,根据m=n×M计算各自质量,配制溶液时注意水的体积不等于溶液的体积;
(2)根据实验步骤进行分析;
(3)根据实验步骤选择仪器;
(4)根据C=
| n |
| V |
解答:
解:(I)(1)胆矾固体放入烧杯中,加水制成溶液时需要用玻璃棒搅拌,加速胆矾固体溶解速度;在蒸发时用玻璃棒搅拌,是为了防止局部温度过高使液滴飞溅;过滤时用到玻璃棒的作用是引流;氧化铜固体和一定质量的氯酸钾固体,混合均匀也需要玻璃棒的搅拌,所以选择①②③④,故答案为:①②③④;
(2)ag胆矾中含铜元素质量为ag×
=
a,设能制得氧化铜的质量为X,根据铜守恒由X×
═
a解得X=
a,所以由胆矾制备氧化铜的产率:
×100%=
,故答案为:
;
(3)由于需要证明反应前后氧化铜的质量不变,反应后先将氧化铜从混合物中分离出来:加水溶解,进行过滤,得到的氧化铜上有氯化钾溶液,进行洗涤干燥,再进行称量,故答案为:cadbe;
(4)通过对比实验才能说明氧化铜的确加快了氯酸钾的反应速度,另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢,现象很明显,
故答案为:对比实验,称取相等质量的氯酸钾,加热,比较产生相同体积氧气所需的时间,或比较在相同时间内产生氧气的体积.
(II)(1)配制200mL 1mol?L-1的CuSO4溶液,应选用250ml的容量瓶配置250ml,则溶质的物质的量为:n=c×V=0.25L×1mol/L=0.25mol,需要溶质的质量为:m(CuSO4)=0.25mol×160g/mol=40g,或m(CuSO4?5H20)=0.25mol×250g/mol=62.5g.
A、应称取40g无水硫酸铜,配成250mL溶液,故A错误;
B、250mL的容量瓶中配不到200mL溶液,故B错误;
C、应称取40g无水硫酸铜,配成250mL溶液,水的体积不等于溶液的体积,故C错误;
D、称取62.5gCuSO4?5H2O,在250mL的容量瓶中配成250mL溶液,故D正确.
故选D;
(2)物质的量浓度思维配置步骤一般为称量、溶解、转移、洗涤、定容、摇匀,故答案为:DAFCBE;
(3)根据实验步骤选用的主要仪器有天平、钥匙、玻璃棒、烧杯、250mL容量瓶、胶头滴管,故答案为:玻璃棒、250mL容量瓶、胶头滴管;
(4)①如果不冷却,则热的溶液转移到容量瓶中,由于热胀冷缩等到室温时体积偏小,根据C=
,浓度偏高,故答案为:偏高;
②洗涤液转入容量瓶后要振荡,若不振荡会使溶液体积偏小,根据C=
,浓度偏高,故答案为:偏高;
③若仰视会使体积偏大,根据C=
,浓度偏低,故答案为:偏低;
④用胶头滴管向容量瓶中加水时,不慎超过刻度线,用胶头滴管从瓶中吸出部分溶液使剩余溶液刚好达刻度线,会使溶质变少,根据C=
,浓度偏低,故答案为:偏低;
⑤使用洁净的容量瓶前,瓶中残留有少量蒸馏水,不会产生影响,故答案为:无影响.
(2)ag胆矾中含铜元素质量为ag×
| 64 |
| 250 |
| 32 |
| 125 |
| 64 |
| 80 |
| 32 |
| 125 |
| 8 |
| 25 |
| b | ||
|
| 25b |
| 8a |
| 25b |
| 8a |
(3)由于需要证明反应前后氧化铜的质量不变,反应后先将氧化铜从混合物中分离出来:加水溶解,进行过滤,得到的氧化铜上有氯化钾溶液,进行洗涤干燥,再进行称量,故答案为:cadbe;
(4)通过对比实验才能说明氧化铜的确加快了氯酸钾的反应速度,另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢,现象很明显,
故答案为:对比实验,称取相等质量的氯酸钾,加热,比较产生相同体积氧气所需的时间,或比较在相同时间内产生氧气的体积.
(II)(1)配制200mL 1mol?L-1的CuSO4溶液,应选用250ml的容量瓶配置250ml,则溶质的物质的量为:n=c×V=0.25L×1mol/L=0.25mol,需要溶质的质量为:m(CuSO4)=0.25mol×160g/mol=40g,或m(CuSO4?5H20)=0.25mol×250g/mol=62.5g.
A、应称取40g无水硫酸铜,配成250mL溶液,故A错误;
B、250mL的容量瓶中配不到200mL溶液,故B错误;
C、应称取40g无水硫酸铜,配成250mL溶液,水的体积不等于溶液的体积,故C错误;
D、称取62.5gCuSO4?5H2O,在250mL的容量瓶中配成250mL溶液,故D正确.
故选D;
(2)物质的量浓度思维配置步骤一般为称量、溶解、转移、洗涤、定容、摇匀,故答案为:DAFCBE;
(3)根据实验步骤选用的主要仪器有天平、钥匙、玻璃棒、烧杯、250mL容量瓶、胶头滴管,故答案为:玻璃棒、250mL容量瓶、胶头滴管;
(4)①如果不冷却,则热的溶液转移到容量瓶中,由于热胀冷缩等到室温时体积偏小,根据C=
| n |
| V |
②洗涤液转入容量瓶后要振荡,若不振荡会使溶液体积偏小,根据C=
| n |
| V |
③若仰视会使体积偏大,根据C=
| n |
| V |
④用胶头滴管向容量瓶中加水时,不慎超过刻度线,用胶头滴管从瓶中吸出部分溶液使剩余溶液刚好达刻度线,会使溶质变少,根据C=
| n |
| V |
⑤使用洁净的容量瓶前,瓶中残留有少量蒸馏水,不会产生影响,故答案为:无影响.
点评:本题综合性较强,需理清催化剂的概念、熟悉物质的量浓度配制得步骤、仪器、误差分析,难度不大,注意基础知识的掌握.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
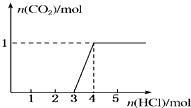 一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )| A、通入的CO2气体在标准状况下等于11.2 L |
| B、溶液中n(NaOH)=2n(Na2CO3) |
| C、A溶液中既含Na2CO3,又含NaHCO3 |
| D、A溶液中一定只有Na2CO3 |
一定条件下,2SO2(g)+O2(g)═2SO3(g)△H=-197kJ?mol-1.现有容积固定且相同的五个容器,在上述条件下分别充入的气体和反应热△H如表所示:根据以上数据,下列选项正确的是( )
| 容器 | SO2(mol) | O2(mol) | SO3 (mol) | He(mol) | △H(kJ?mol-1) |
| 1 | 2 | 1 | 0 | 0 | △H1 |
| 2 | 1 | 0.5 | 0 | 0 | △H2 |
| 3 | 1 | 0.5 | 0 | 1 | △H3 |
| 4 | 1 | 0.6 | 0 | 0 | △H4 |
| 5 | 0 | 0 | 2 | 0 | △H5 |
| A、△H1=2△H2 |
| B、△H3<△H4 |
| C、△H1+△H5=197 |
| D、△H2=△H3 |
将一定量的有机物充分燃烧后的产物先通入浓硫酸,浓硫酸增重5.4g,然后通入足量澄清石灰水中,完全吸收后,经过滤得到20g沉淀,该有机物可能是( )
| A、乙烯 | B、乙醇 |
| C、甲酸甲酯 | D、乙酸 |
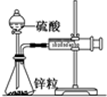 某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )
某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )| A、用锌粒表示10 s内该反应的速率为0.013 g?s-1 |
| B、忽略锥形瓶溶液体积的变化,用H+来表示10 s该反应的速率0.01 mol?(L?s)-1 |
| C、忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol?(L?s)-1 |
| D、用H2表示10 s内该反应的速率为0.004 mol?(L?s)-1 |
 常温下,向25mL 0.1mol/LMOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(假设混合后溶液体积的微小变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/LMOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(假设混合后溶液体积的微小变化忽略不计).回答下列问题: 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下. 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.