题目内容
12.在标准状况下,CO和CO2混合气体的质量为36g,体积为22.4L,则CO所占的体积为11.2L,CO2的质量为22g.分析 根据n=$\frac{V}{Vm}$计算混合气体的物质的量,令混合气体中CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与物质的量之和列放出计算x、y的值,再根据V=nVm计算CO的体积,根据m=nM计算CO2的质量.
解答 解:标准状况下,混合气体的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,
令混合气体中CO和CO2的物质的量分别为xmol、ymol,则:
x+y=1;
28x+44y=36
解得:x=0.5,y=0.5;
则CO所占的体积为:22.4L/mol×0.5mol=11.2L;
CO2的质量为:0.5mol×44g/mol=22g;
故答案为:11.2;22.
点评 本题考查物质的量的有关计算、混合物的有关计算等,比较基础,注意对基础知识的理解掌握,注意对公式的理解与运用.

练习册系列答案
相关题目
9.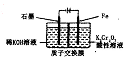 电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
 电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )| A. | 阳极反应为Fe-2e-=Fe2+ | |
| B. | 在阴极室,发生的电极反应为:Cr2O72-+6e-+7H2O=Cr(OH)3+8OH- | |
| C. | 在阳极室,pH增大会有Fe(OH)3沉淀生成 | |
| D. | 电路中每转移12 mol电子,最多有1 mol Cr2O72- 被还原 |
3.四种短周期元素X、Y、Z、W,已知X、Y的阳离子a Xn+、b Y(n+1)+电子层结构与Z、W的阴离子c Zm-、d W(m+1)-电子层结构相同.下列叙述正确的是( )
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z<W | |
| D. | 还原性Z m->W(m+1)-,氧化性Xn+>Y(n+1)+ |
20.下列叙述正确的是( )
| A. | 阿伏加德罗常数个硫酸分子里含有4molO | |
| B. | CH4的摩尔质量为16g | |
| C. | lmolFe的质量为56g/mol | |
| D. | lmolNH3为18g |
1.甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质.已知:A+B=D+F,A+C=E+F;0.1mol•L-1D溶液的pH为13(25℃),下列说法正确的是( )
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 乙元素在周期表中的位置为第三周期第Ⅳ族 | |
| C. | 1molA与足量B完全反应共转移1mol电子 | |
| D. | 1.0mol•L-1E溶液中阴离子总的物质的量小于0.1mol |
2.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;继续加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在.
该白色粉末可能为( )
①取少量样品加入足量水仍有部分固体未溶解;继续加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在.
该白色粉末可能为( )
| A. | Na2CO3、Al(OH)3 | B. | AgCl、NaHCO3 | C. | NaHCO3、BaCO3 | D. | Na2SiO3、CuO |