题目内容
20.设NA为阿伏加德罗常数的值,下列说法中正确的是( )| A. | 1mol乙基中含有的电子数为13NA | |
| B. | 标准状况下,22.4L三氯甲烷中共价键数目为4NA | |
| C. | 6.4gCaC2晶体中含有阴阳离子总数为0.3NA | |
| D. | 1mol硫粉与足量的Cu粉共热,转移的电子数为2NA |
分析 A、乙基不显电性;
B、标况下三氯甲烷为液态;
C、求出碳化钙的物质的量,然后根据1mol碳化钙中含1molC22-来分析;
D、硫与铜反应后变为-2价.
解答 解:A、乙基不显电性,故1mol乙基中含17mol电子即17NA个,故A错误;
B、标况下三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、6.4g碳化钙的物质的量为0.1mol,而1mol碳化钙中含1mol钙离子和1molC22-,故0.1mol碳化钙中含0.1mol阳离子和0.1mol阴离子,共0.2NA个,故C错误;
D、硫与铜反应后变为-2价,故1mol硫转移2mol电子即2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
11.等质量的CH4和NH3相比较,下列结论中错误的是( )
| A. | 两种气体的分子个数之比为17:16 | |
| B. | 两种气体的原子个数之比为17:16 | |
| C. | 两种气体的氢原子个数之比为17:12 | |
| D. | 同温同压下,两种气体的体积之比为17:16 |
8.10g镁铝合金与足量的氢氧化钠溶液反应后,生成气体3.36L(标准状况),则此合金中含镁的质量分数为( )
| A. | 35.6% | B. | 27% | C. | 10% | D. | 73% |
5.下列说法或表示法正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 | |
| D. | 酸与碱恰好完全反应生成正盐,其中c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 |
9.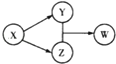 X、Y、Z、W四种物质的转化关系.下列组合中不符合该关系的是( )
X、Y、Z、W四种物质的转化关系.下列组合中不符合该关系的是( )
 X、Y、Z、W四种物质的转化关系.下列组合中不符合该关系的是( )
X、Y、Z、W四种物质的转化关系.下列组合中不符合该关系的是( )| A | B | C | D | |
| X | HCl | Na2CO3 | Na2O2 | SO2 |
| Y | FeCl2 | CO2 | NaOH | Na2SO3 |
| Z | Cl2 | CaCO3 | Na2CO3 | H2SO4 |
| W | FeCl3 | Ca(HCO3)2 | NaHCO3 | NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |
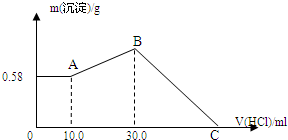 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.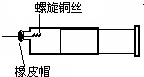 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生. 和一个“-Br”,A的结构简式为(CH3)2CHCHBrCH3.
和一个“-Br”,A的结构简式为(CH3)2CHCHBrCH3.