题目内容
10.图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;Ⅳ、Ⅴ、Ⅵ是气体收集装置,根据要求回答下列问题:(1)若用MnO2与浓盐酸反应制取氯气,应选用发生装置Ⅰ,用方程式表示制取氯气的反应原理是MnO2+4HC1(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+C12↑+2H2O.
(2)若用KMnO4与浓盐酸反应制取氯气,应选用发生装置Ⅲ,试完成并配平下列离子方程式:
2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O.
(3)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用氢氧化钠溶液浸湿,其作用是防止氯气逸出污染空气.
(4)若选用Ⅴ为氯气收集装置,则氯气应从A口通入.用化学方法检验氯气收集满了的方法是将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满.
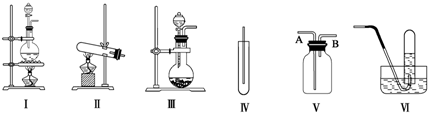
分析 (1)根据反应物的状态及反应条件确定反应装置;二氧化锰和浓盐酸反应生成氯化锰、氯气和水,注意二氧化锰和浓盐酸反应和稀盐酸不反应;
(2)根据反应物的状态及反应条件确定反应装置;根据氧化还原反应中得失电子相等配平方程式;
(3)根据氯气的性质确定收集方法,注意氯气有毒,不能使氯气逸出污染空气;
(4)根据氯气的密度选择排空气的方法;氯气的氧化性大于碘的氧化性,碘遇淀粉变蓝色.
解答 解:(1)二氧化锰和浓盐酸的反应是固液混合加热型,所以选择Ⅰ装置;在加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水,MnO2+4HC1(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+C12↑+2H2O,
故答案为:Ⅰ;MnO2+4HC1(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+C12↑+2H2O;
(2)KMnO4与浓盐酸的反应是固液混合不需要加热的,所以应选择Ⅲ装置;MnO4-中锰元素的化合价是+7价,Mn2+的化合价是+2价,所以一个MnO4-生成Mn2+得5个电子,生成一个C12分子需要2个氯离子失去2个电子,所以得失电子的最小公倍数是10,再根据元素守恒知,生成物中还有水;所以该离子方程式中的计量数分别为:2、10、16、2、5、8,
故答案为:Ⅲ;2;10;16;2;5;8H2O;
(3)氯气有毒,逸出会污染大气,所以不能让氯气逸出;氯气和水能反应是盐酸和次氯酸,盐酸和次氯酸是酸,都能和碱反应,所以可用氢氧化钠溶液吸收氯气,
故答案为:氢氧化钠;防止氯气逸出污染空气;
(4)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口;氯气的氧化性大于碘的氧化性,所以氯气能置换出碘化钾中的碘,且碘遇淀粉变蓝色,所以可用湿润的淀粉KI试纸检验是否收集满了氯气.
故答案为:A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满.
点评 本题考查了氯气的实验室制法、离子方程式的配平、气体的检验等知识点,难度不大,注意根据反应物的状态及反应条件选择相应的装置.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案| A. | 1mol乙基中含有的电子数为13NA | |
| B. | 标准状况下,22.4L三氯甲烷中共价键数目为4NA | |
| C. | 6.4gCaC2晶体中含有阴阳离子总数为0.3NA | |
| D. | 1mol硫粉与足量的Cu粉共热,转移的电子数为2NA |
| A. | 标准状况下,11.2 L的甲醇所含的氢原子数大于2NA | |
| B. | 常温下,1mol•L-1的Na2CO3溶液中CO32-的个数必定小于NA | |
| C. | 1mol Cu与含2mol H2SO4,的浓硫酸充分反应,生成的S02的分子个数为NA | |
| D. | 1mol苯分子中含有3NA个碳碳双键 |
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
| A. | 1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 强酸和强碱的稀溶液发生中和反应一定是放热反应,弱酸和弱碱反应一定也是放热反应 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应 | |
| D. | 酸和碱发生中和反应生成1 mol 水,这时的反应热叫中和热 |
| A. | 小于1nm | B. | 在1nm~100nm间 | C. | 大于100nm | D. | 无法确定 |

 .
.