题目内容
10.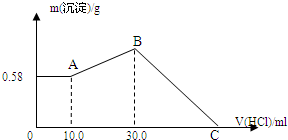 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
(1)混合物中各物质的物质的量:
NaOH是0.065mol,
AlCl3是0.01mol,
MgCl2是0.01mol.
(2)C点所加的盐酸的体积是130mL.
分析 固体组成的混合物溶于足量水后,再加入盐酸时,0-A时沉淀的质量不变,说明溶液中NaOH过量,加入10 mL 盐酸恰好中和过量的NaOH,再加盐酸沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀物为 Mg(OH)2,其物质的量为$\frac{0.58g}{58g/mol}$=0.01mol,根据镁原子守恒计算n(MgCl2);
AB段发生反应:[Al(OH)4]-+H+=Al(OH)3↓+H2O,B点溶液中存在的溶质是NaCl,沉淀为Mg(OH)2、Al(OH)3,B点后发生反应:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O;
由AB段消耗盐酸,结合反应方程式、Al原子守恒计算n(AlCl3),B点溶液中存在的溶质是氯化钠,根据原子守恒可知n(NaOH)=n(NaCl),则原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl);
C点溶液为MgCl2、AlCl3和NaCl混合液,由氯离子守恒可知,氯化钠中氯离子源于加入盐酸,根据钠离子守恒可知m(NaOH)=n(NaCl),进而计算加入盐酸的体积.
解答 解:(1)固体组成的混合物溶于足量水后,再加入盐酸时,0-A时沉淀的质量不变,说明溶液中NaOH过量,加入10 mL 盐酸恰好中和过量的NaOH,再加盐酸沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀物为 Mg(OH)2,其物质的量为$\frac{0.58g}{58g/mol}$=0.01mol,根据镁原子守恒,n(MgCl2)=n[Mg(OH)2]=$\frac{0.58}{58g/mol}$=0.01mol;
AB段发生反应:[Al(OH)4]-+H+=Al(OH)3↓+H2O,则n[Al(OH)3]=n(HCl)=0.5mol/L×(0.03-0.01)L=0.01mol,根据铝原子守恒得n(AlCl3)=n[Al(OH)3]=0.01mol;
B点溶液中存在的溶质是NaCl,沉淀为Mg(OH)2、Al(OH)3,B点后发生反应:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O,B点溶液中存在的溶质是NaCl,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol,
故答案为:0.065mol;0.01mol;0.01mol;
(2)C点溶液为MgCl2、AlCl3和NaCl混合液,由氯离子守恒可知,氯化钠中氯离子源于加入盐酸,根据钠离子守恒可知m(NaOH)=n(NaCl)=0.065mol,C点加入盐酸的体积为$\frac{0.065mol}{0.5mol/L}$=0.13L=130mL,
故答案为:130.
点评 本题考查混合物有关计算,关键是明确每阶段发生的反应,再结合原子守恒来分析解答,(2)注意从化学式变化来分析,侧重考查学生分析计算能力,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )
分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )| A. | 该图表示的是乙烯分子的球棍模型 | |
| B. | 该烃分子是非极性分子 | |
| C. | 该烃的电子式为: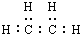 | |
| D. | 该烃分子中半径较大的原子其核外电子排布的轨道表示式为: |
| A. | 60 mL | B. | 90 mL | C. | 120 mL | D. | 45 mL |
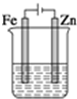
| A. | 溶液中氯离子向锌电极移动 | B. | 锌电极上生成氧化产物 | ||
| C. | 两端电极产生相等体积的气体 | D. | 电路中电子转移数为0.4NA |
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
②B溶液与其它四种溶液反应,均能产生沉淀;
③向C溶液中逐滴加入B溶液,有白色沉淀生成,当B溶液过量时,沉淀完全溶
解.
回答下列问题:
(1)写出下列物质的化学式:AH2SO4、BBa(OH)2.
(2)D、E两种物质中必有一种是NH4HCO3,写出将少量该物质的稀溶液滴加到0.1mol/L B溶液中反应的离子方程式Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O.
(3)用铝粉可除去废水中的NO3-.在pH为10.7左右的溶液中,加入铝粉除去NO3-,同时产生物质的量之比为1﹕1的氨气和氮气,该反应的还原产物是NH3、N2,除去0.1mol NO3-,要消耗铝5.4g,其对应离子方程式为6Al+3NO3-+3OH-=6AlO2-+NH3↑+N2↑.
| A. | 1mol乙基中含有的电子数为13NA | |
| B. | 标准状况下,22.4L三氯甲烷中共价键数目为4NA | |
| C. | 6.4gCaC2晶体中含有阴阳离子总数为0.3NA | |
| D. | 1mol硫粉与足量的Cu粉共热,转移的电子数为2NA |