题目内容
5.下列说法或表示法正确的是( )| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 | |
| D. | 酸与碱恰好完全反应生成正盐,其中c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 |
分析 A、化学反应一定伴随着能量的变化;
B、2g氢气是1mol,注意热化学方程式的化学计量数;
C、化学反应速率改变不一定会引起化学平衡的移动;
D、c(H+)=c(OH-)的溶液一定呈中性.
解答 解:A、在化学反应过程中,发生物质变化即有化学键的断裂和形成,而断裂化学键要吸收能量,形成化学键放出能量,故有物质变化的同时一定有能量变化,故A错误;
B、2g氢气是1mol,放出285.8kJ热量,则2mol放出571.6kJ,则热化学方程式应为:H2(g)$\frac{1}{2}$+O2(g)═H2O(l);△H=-285.8kJ•mol-1,故B错误;
C、温度引起化学反应速率的改变,一定会引起化学平衡的移动;浓度改变一定会引起速率的改变,但化学平衡不一定会移动,如将反应2HI?H2+I2的反应容器体积缩小,则HI、H2、I2的浓度均增大,正逆反应速率均加快,但平衡不移动,故C错误;
D、c(H+)=c(OH-)的溶液一定呈中性,故D正确.
故选D.
点评 本题涉及化学的基本概念和基本理论知识,属于综合知识的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和水,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS 与HNO3的物质的量之比为( )
| A. | 1:6 | B. | 1:7 | C. | 2:11 | D. | 16:25 |
20.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1mol乙基中含有的电子数为13NA | |
| B. | 标准状况下,22.4L三氯甲烷中共价键数目为4NA | |
| C. | 6.4gCaC2晶体中含有阴阳离子总数为0.3NA | |
| D. | 1mol硫粉与足量的Cu粉共热,转移的电子数为2NA |
10.下列关于金属的描述不正确的是( )
| A. | 金属单质都有还原性 | |
| B. | 镁、铝虽然还原性较强,但可以直接置于空气中保存,是因为表面能形成致密的氧化膜,保护了内层的金属 | |
| C. | 铝箔在酒精灯上加热后熔化但不滴落,是因为表面形成的Al2O3层熔点很高 | |
| D. | 钠和镁可以剧烈地燃烧,铝和铁则不能燃烧 |
17.Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为4Li+2SOCl2═4LiCl+S+SO2,下列说法错误的是( )
| A. | 该电池工作时,正极反应为2SOCl2+4e-═4Cl-+S+SO2 | |
| B. | 锂电极作该电池负极,负极反应为Li-e-═Li+ | |
| C. | 该电池组装时,必须在无水无氧条件下进行 | |
| D. | 该电池工作时,电子通过外电路从正极流向负极 |
15.铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途.下列关于铝的说法不正确的是( )
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
 取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题:
取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题: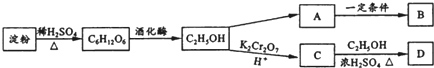
 .
. ;
;
 .
.