题目内容
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
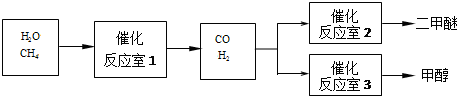
请填空:
(1)一定条件下,反应室1中发生反应CH4(g)+H2O(g)═CO(g)+3H2(g)△H>0.其它条件不变,只降低温度,逆反应速率将 (填“增大”、“减小”或“不变”).
(2)图1中反应室3(容积可变的密闭容器)中0.2mol CO与0.4mol H2在催化剂作用下发生可逆反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:
①P1 P2 (填“<”、“>”或“=”).
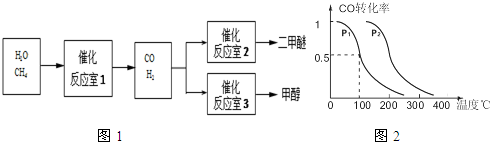
②在压强P1下,100℃时反应达到化学平衡,反应室3的容积变为2L,此时 若温度不变,再加入1.0mol CO后重新达到平衡,CO的平衡转化率 (填“增大”、“不变”或“减小”).
③保持容积为2L不变,温度100℃不变,向反应室3中再通入0.2mol CO与0.4mol H2,CO的平衡转化率 (填“增大”、“不变”或“减小”).

请填空:
(1)一定条件下,反应室1中发生反应CH4(g)+H2O(g)═CO(g)+3H2(g)△H>0.其它条件不变,只降低温度,逆反应速率将
(2)图1中反应室3(容积可变的密闭容器)中0.2mol CO与0.4mol H2在催化剂作用下发生可逆反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:
①P1

②在压强P1下,100℃时反应达到化学平衡,反应室3的容积变为2L,此时 若温度不变,再加入1.0mol CO后重新达到平衡,CO的平衡转化率
③保持容积为2L不变,温度100℃不变,向反应室3中再通入0.2mol CO与0.4mol H2,CO的平衡转化率
考点:化学平衡的影响因素,转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:(1)降低温度,正逆化学反应速率都会减小;
(2)①根据温度和压强对化学平衡移动的影响来回答;
②若温度不变,再加入1.0molCO,平衡向正反应移动,重新达到平衡,氢气的转化率增大,CO的转化率减小;
③再增加0.2molCO与0.4molH2,等效为增大压强,平衡向正反应移动.
(2)①根据温度和压强对化学平衡移动的影响来回答;
②若温度不变,再加入1.0molCO,平衡向正反应移动,重新达到平衡,氢气的转化率增大,CO的转化率减小;
③再增加0.2molCO与0.4molH2,等效为增大压强,平衡向正反应移动.
解答:
解:(1)降低温度,正逆化学反应速率都会减小,故答案为:减小;
(2)①温度不变,增大压强,平衡CO(g)+2H2(g)?CH3OH(g)正向移动,所以CO的平衡转化率会增大,即P1<P2,故答案为:<;
②若温度不变,再加入1.0molCO,平衡向正反应移动,重新达到平衡,CO的转化率减小,故答案为:减小;
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,等效为增大压强,平衡向正反应移动,CO转化率增大,故答案为:增大.
(2)①温度不变,增大压强,平衡CO(g)+2H2(g)?CH3OH(g)正向移动,所以CO的平衡转化率会增大,即P1<P2,故答案为:<;
②若温度不变,再加入1.0molCO,平衡向正反应移动,重新达到平衡,CO的转化率减小,故答案为:减小;
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,等效为增大压强,平衡向正反应移动,CO转化率增大,故答案为:增大.
点评:本题考查化学反应速率、影响平衡的因素、化学平衡常数、化学平衡图象等,难度中等.

练习册系列答案
相关题目
某有机物的结构简式为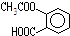 ,它可以发生的反应类型有( )
,它可以发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚 ⑧加聚.
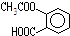 ,它可以发生的反应类型有( )
,它可以发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚 ⑧加聚.
| A、只有①②④⑤ |
| B、只有①②④⑤⑥ |
| C、只有①②④⑤⑥⑦ |
| D、只有①②④⑤⑥⑧ |
要使在容积恒定的密闭容器中进行的可逆反应2A(g)+B(s)?2C(g)的反应速率显著加快,可采用的措施是( )
| A、降温 | B、加入B |
| C、充入氦气,使压强增大 | D、加入A |