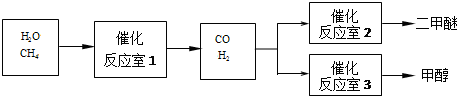
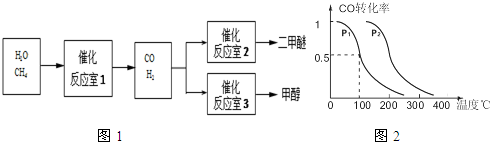
题目内容
要使在容积恒定的密闭容器中进行的可逆反应2A(g)+B(s)?2C(g)的反应速率显著加快,可采用的措施是( )
| A、降温 | B、加入B |
| C、充入氦气,使压强增大 | D、加入A |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:对于反应2A(g)+B(s)?2C(g)来说,增大浓度、温度、压强或加入催化剂都可增大反应速率,注意B为固体的特点,以此解答.
解答:
解:A.降低温度,反应速率减小,故A错误;
B.B为固体,加入B,反应速率不变,故B错误;
C.充入氦气,使压强增大,但反应气体的浓度不变,则反应速率不变,故C错误;
D.加入A,则气体浓度增大,反应速率增大,故D正确.
故选D.
B.B为固体,加入B,反应速率不变,故B错误;
C.充入氦气,使压强增大,但反应气体的浓度不变,则反应速率不变,故C错误;
D.加入A,则气体浓度增大,反应速率增大,故D正确.
故选D.
点评:本题考查化学反应速率的影响,侧重于学生的分析能力的考查,为高考常见题型,把握B为固体的特点,为解答该题的关键,难度不大,答题时注意审题,把握题给信息.

练习册系列答案
相关题目
下列各组物质中,分子数相同的是( )
| A、2L SO2和2L CO2 |
| B、0.5mol水和标准状况下11.2L CO2 |
| C、标准状况下1mol氧气和22.4L水 |
| D、0.2mol硫化氢气体和2.24 L氯化氢气体 |
在0.1mol/L的NH3?H2O溶液中存在如下电离平衡:NH3?H2O?NH4++OH-对于该平衡,下列叙述正确的是( )
| A、加入少量NaOH固体,溶液中c(OH-)减少 |
| B、通入少量HCl气体,平衡向正反应方向移动 |
| C、加水,反应速率增大,平衡向逆反应方向移动 |
| D、加入少量NH4Cl固体,平衡向正反应方向移动 |
电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法正确的是( )
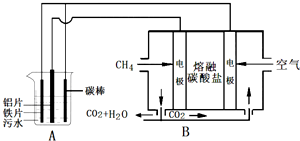

| A、装置A中碳棒为阴极 |
| B、装置B中通入空气的电极反应是O2+2H2O+4e-═4OH- |
| C、污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果 |
| D、标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH4 11.2L |
盐酸、醋酸和碳酸氢钠是生活中常见的物质.下列表述正确的是( )
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C、10mL 0.20mol?L-1 CH3COOH溶液加入10mL 0.10mol?L-1的NaOH后,溶液中:c(CH3COO-)+c(CH3COOH)=0.10mol?L-1 |
| D、中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
下列反应的离子方程式书写正确的是( )
| A、铝与氢氧化钠溶液反应:Al+4OH-═[Al(OH)4]-+H2↑ |
| B、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O═[Al(OH)4]-+4NH4+ |
| C、氯化铁溶液中加入铜粉:Fe3++Cu═Cu2++Fe2+ |
| D、氯化铜溶液中加入锌粉:Cu2++Zn═Cu+Zn2+ |
某有机化合物具有下列化学性质,则该有机化合物可能是( )
①能与钠反应放出气体 ②能使溴水褪色 ③能溶解氢氧化铜固体 ④能与碳酸钠固体反应放出气体.
①能与钠反应放出气体 ②能使溴水褪色 ③能溶解氢氧化铜固体 ④能与碳酸钠固体反应放出气体.
A、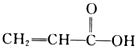 |
B、 |
| C、CH2=CH-CH2OH |
D、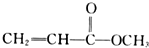 |