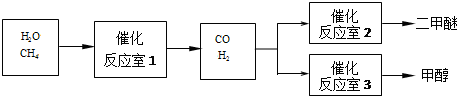
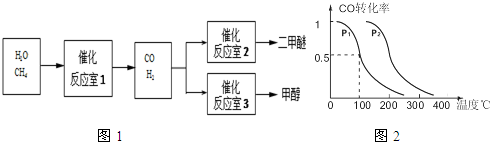
题目内容
373K下,A(g)═2B(g)在一密闭容器中进行.
(1)此反应的平衡常数K= (填表达式).
(2)A(g)═2B(g)在不同温度(T )下的K值如表,则该反应的逆反应为 (填“吸热”或
“放热”)反应.
(3)升高温度,该平衡向 (填“向左”、“向右”或“不”)移动,反应速率 (填“增大”、“减小”或“不变”).
(4)373K下,A(g)═2B(g)在前110s内的反应进程如图(将该反应看作匀速进行).
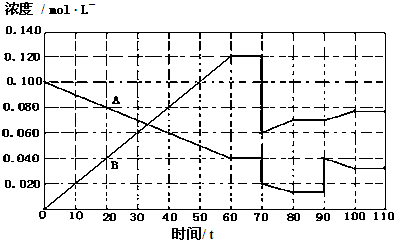
初始加入气体A,据图判断:
①80-90s内,平衡向哪个方向移动? (填“向左”、“向右”或“不移动”);
②90s时,图中线条变化的原因是 ;
③70s时,图中线条发生变化对应的条件可能是 (填标号).
A.加入催化剂 B.扩大容器体积 C.升高温度 D.增大A的浓度.
| T/K | 273 | 323 | 373 |
| K | 0.005 | 0.022 | 0.36 |
(2)A(g)═2B(g)在不同温度(T )下的K值如表,则该反应的逆反应为
“放热”)反应.
(3)升高温度,该平衡向
(4)373K下,A(g)═2B(g)在前110s内的反应进程如图(将该反应看作匀速进行).

初始加入气体A,据图判断:
①80-90s内,平衡向哪个方向移动?
②90s时,图中线条变化的原因是
③70s时,图中线条发生变化对应的条件可能是
A.加入催化剂 B.扩大容器体积 C.升高温度 D.增大A的浓度.
考点:化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据化学方程式和平衡常数概念书写表达式;
(2)依据图标数据分析,随温度升高平衡常数增大,正反应方向进行为吸热反应;
(3)反应为吸热反应,升温增大反应速率,平衡正向进行;
(4)①依据图象分析可知,80s-90s是A、B浓度不变的过程,平衡不动;
②90s时,图中线条变化B浓度增大,A浓度突然增大后,B此时浓度不变,随反应进行A的浓度减少,说明平衡正向进行;
③70s时,图中线条发生变化,B浓度突然减小一半,A的浓度也在此时减小一半,说明是增大容器体积;
(2)依据图标数据分析,随温度升高平衡常数增大,正反应方向进行为吸热反应;
(3)反应为吸热反应,升温增大反应速率,平衡正向进行;
(4)①依据图象分析可知,80s-90s是A、B浓度不变的过程,平衡不动;
②90s时,图中线条变化B浓度增大,A浓度突然增大后,B此时浓度不变,随反应进行A的浓度减少,说明平衡正向进行;
③70s时,图中线条发生变化,B浓度突然减小一半,A的浓度也在此时减小一半,说明是增大容器体积;
解答:
解:(1)化学方程式为:A(g)═2B(g),依据平衡常数概念书写表达式K=
;
故答案为:
;
(2)依据图标数据分析,随温度升高平衡常数增大,正反应方向进行为吸热反应,逆反应为放热反应;
故答案为:放热;
(3)上述分析判断此反应为吸热反应,升高温度,增大反应速率,平衡向吸热反应方向进行,平衡正向进行,逆反应为放热反应;
故答案为:向右,增大;
(4)①图象分析可知,80s-90s是A、B浓度不变的过程,平衡不动;
故答案为:不移动;
②90s时,图中线条变化B浓度增大,A浓度突然增大后,B此时浓度不变,说明改变的条件是增大A的浓度,随反应进行A的浓度减少,说明平衡正向进行;
故答案为:增大A的浓度;
③70s时,图中线条发生变化,B浓度突然减小一半,A的浓度也在此时减小一半,说明是增大容器体积,随压强减小,平衡正向进行,AB反应速率减小,最后达到新的平衡状态;
A.加入催化剂加快反应速率,不改变平衡状态,故A不符合;
B.扩大容器体积,AB浓度减小,平衡正向进行,符合题意,故B正确;
C.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,速率变化不符合,故C不符合;
D.70s时,图中线条发生变化,B浓度突然减小一半,A的浓度也在此时减小一半,增大A的浓度不符合图象变化,故C不符合;
故答案为:B;
| c2(B) |
| c(A) |
故答案为:
| c2(B) |
| c(A) |
(2)依据图标数据分析,随温度升高平衡常数增大,正反应方向进行为吸热反应,逆反应为放热反应;
故答案为:放热;
(3)上述分析判断此反应为吸热反应,升高温度,增大反应速率,平衡向吸热反应方向进行,平衡正向进行,逆反应为放热反应;
故答案为:向右,增大;
(4)①图象分析可知,80s-90s是A、B浓度不变的过程,平衡不动;
故答案为:不移动;
②90s时,图中线条变化B浓度增大,A浓度突然增大后,B此时浓度不变,说明改变的条件是增大A的浓度,随反应进行A的浓度减少,说明平衡正向进行;
故答案为:增大A的浓度;
③70s时,图中线条发生变化,B浓度突然减小一半,A的浓度也在此时减小一半,说明是增大容器体积,随压强减小,平衡正向进行,AB反应速率减小,最后达到新的平衡状态;
A.加入催化剂加快反应速率,不改变平衡状态,故A不符合;
B.扩大容器体积,AB浓度减小,平衡正向进行,符合题意,故B正确;
C.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,速率变化不符合,故C不符合;
D.70s时,图中线条发生变化,B浓度突然减小一半,A的浓度也在此时减小一半,增大A的浓度不符合图象变化,故C不符合;
故答案为:B;
点评:本题考查了化学平衡影响因素,平衡常数计算分析,平衡标志的分析判断,掌握图象分析方法和平衡移动原理是解题关键,题目难度中等.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
在含有大量Ba2+、OH-、Cl-的溶液中还可能大量存在的离子是( )
| A、NH4+ |
| B、Ag+ |
| C、NO3- |
| D、SO42- |
下列各组物质中,分子数相同的是( )
| A、2L SO2和2L CO2 |
| B、0.5mol水和标准状况下11.2L CO2 |
| C、标准状况下1mol氧气和22.4L水 |
| D、0.2mol硫化氢气体和2.24 L氯化氢气体 |
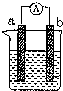 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: