题目内容
15.有关下如图所示原电池的叙述不正确的是( )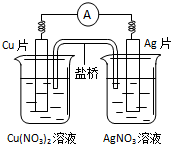
| A. | 电子沿导线由Cu片流向Ag片 | |
| B. | 正极的电极反应是Ag++e-=Ag | |
| C. | Cu片上发生氧化反应,Ag片上发生还原反应 | |
| D. | 反应时盐桥中的阳离子移向Cu(NO3)2溶液 |
分析 该装置是含有盐桥的原电池,铜比银活泼,则铜作负极,负极上铜失电子发生氧化反应,正极上银离子得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:A.该装置是原电池,铜作负极,银作正极,电子从铜片沿导线流向银片,故A正确;
B.正极上银离子得电子发生还原反应,电极反应式为:Ag++e-=Ag,故B正确;
C.铜片上失电子发生氧化反应,银片上得电子发生还原反应,故C正确;
D.原电池工作时,阳离子向正极移动,钾离子移向硝酸银溶液,但是盐桥中的阳离子只在盐桥中移动,不会进入电解质,故D错误.
故选D.
点评 本题考查原电池原理,为高频考点,侧重于学生的分析能力的考查,明确原电池中正负极上得失电子及其发生反应的类型是解本题关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
6.1摩单质碳在二氧化碳和氧气的混合气体中高温燃烧,生成气体的物质的量可能是( )
| A. | 2摩 | B. | 2.5摩 | C. | 1.5摩 | D. | 3摩 |
3.同温同压下,甲容器内充满了H2气体,乙容器内充满了NH3气体,如果两者氢原子个数相等,则这两个容器的体积比为( )
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 3:1 |
10.表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明.
(1)已知碘在碘酸钾中的化合价为+5,1mol碘酸钾中共含5mol原子,则碘酸钾的化学式为KIO3.
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
KIO3+5KI+3H2SO4-3K2SO4+3I2+3H2O
(3)要使上述反应生成的I2从溶液中分离出来,某学生设计如下的操作步骤:
A.检验分液漏斗活塞和上口的玻璃塞是否检漏;
B.把10mL碘水和4mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.充分振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
F.静置
G.旋开活塞,用烧杯接收下层I2的有机溶液;
H.从分液漏斗上口倒出上层液体;
①补全上述操作A检漏C充分振荡 F静置②该实验中用的萃取剂是四氯化碳
③从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏(填操作名称)
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是不稳定,受热易分解.
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为I2+2KClO3=2KIO3+Cl2.
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
KIO3+5KI+3H2SO4-3K2SO4+3I2+3H2O
(3)要使上述反应生成的I2从溶液中分离出来,某学生设计如下的操作步骤:
A.检验分液漏斗活塞和上口的玻璃塞是否检漏;
B.把10mL碘水和4mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.充分振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
F.静置
G.旋开活塞,用烧杯接收下层I2的有机溶液;
H.从分液漏斗上口倒出上层液体;
①补全上述操作A检漏C充分振荡 F静置②该实验中用的萃取剂是四氯化碳
③从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏(填操作名称)
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是不稳定,受热易分解.
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为I2+2KClO3=2KIO3+Cl2.
7.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
4.下列叙述正确的是( )
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 没有单质参加的反应一定不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 化合反应一定是氧化还原反应 |
5.100mL 6mol/L硫酸溶液与过量锌粒反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可采取的措施是( )
| A. | 加入少量碳酸钠粉末 | B. | 加入少量硫酸铜溶液 | ||
| C. | 加入适量NaCl溶液 | D. | 加热 |
 表示的分子式C6H14,结构简式(CH3)2CHCH2CH2CH3,名称是2-甲基戊烷.
表示的分子式C6H14,结构简式(CH3)2CHCH2CH2CH3,名称是2-甲基戊烷.