题目内容
7.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
分析 短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,原子序数:a>b>d>c,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属,且A、B在周期表中C、D的下一周期,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,原子序数:a>b>d>c,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属,且A、B在周期表中C、D的下一周期,
A.A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,原子核外电子层数越多,半径越大,同周期元素原子序数越大,半径越小,则有原子半径:B>A>C>D,故A错误;
B.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,所以原子序数:a>b>d>c,故B错误;
C.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数a>b>d>c,所以离子半径C>D>B>A,故C正确;
D.A、B为同周期金属元素,A离子带的正电荷较多,故最外层电子数A>B,C、D为同周期非金属性元素,C离子所带负电荷较多,故最外层电子数C<D,C、D的族序数大于A、B,故最外层电子数D>C>A>B,故D错误.
故选C.
点评 本题考查位置结构性质的相互关系及应用,为高频考点,侧重于学生的分析能力的考查,根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大,注意由于是短周期元素,可以确定具体的元素.

练习册系列答案
相关题目
18.下列微粒中,属于阳离子的是( )
| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
15.有关下如图所示原电池的叙述不正确的是( )
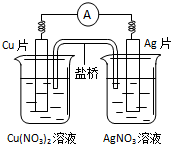

| A. | 电子沿导线由Cu片流向Ag片 | |
| B. | 正极的电极反应是Ag++e-=Ag | |
| C. | Cu片上发生氧化反应,Ag片上发生还原反应 | |
| D. | 反应时盐桥中的阳离子移向Cu(NO3)2溶液 |
2.在下列物质中,既能使溴水褪色,又能使酸性高锰酸钾溶液褪色,还能使紫色石蕊试液变为红色的是( )
| A. | 苯 | B. | 苯酚 | C. | 丙烯酸 | D. | 甲酸甲酯 |
12.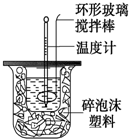 测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )
测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )
 测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )
测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )| A. | 实验中使用的搅拌棒材料为铁 | |
| B. | 读取温度计读数时,读取的是混合溶液的最高温度 | |
| C. | 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 | |
| D. | 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
19.世界卫生组织对塑化剂DEHP(分子式为C24H38O4)规定的每日耐受摄入量为每千克0.025毫克,以体重为78kg的成人来讲,每天摄入1.95毫克及以下的DEHP是安全的.体重为78kg的成人每天摄入下列DEHP时,不安全的是(设NA为阿伏加德罗常数的值)( )
| A. | 5×10-6NA个DEHP分子 | |
| B. | 含有1.2×10-4NA个碳原子的DEHP分子 | |
| C. | 含有2×10-5NA个氧原子的DEHP分子 | |
| D. | 含有2.0×10-4NA个氢原子的DEHP分子 |
16.下列分离物质的方法中,根据微粒大小进行分离的是( )
| A. | 萃取 | B. | 蒸馏 | C. | 分液 | D. | 渗析 |

 ,
, .
.