题目内容
10.表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明.| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
KIO3+5KI+3H2SO4-3K2SO4+3I2+3H2O
(3)要使上述反应生成的I2从溶液中分离出来,某学生设计如下的操作步骤:
A.检验分液漏斗活塞和上口的玻璃塞是否检漏;
B.把10mL碘水和4mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.充分振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
F.静置
G.旋开活塞,用烧杯接收下层I2的有机溶液;
H.从分液漏斗上口倒出上层液体;
①补全上述操作A检漏C充分振荡 F静置②该实验中用的萃取剂是四氯化碳
③从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏(填操作名称)
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是不稳定,受热易分解.
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为I2+2KClO3=2KIO3+Cl2.
分析 (1)碘在碘酸钾中的化合价为+5,1mol碘酸钾中共含5mol原子,K为+1价,0为-2价;
(2)I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,结合电子守恒及质量守恒定律分析;
(3)可用萃取、分液的方法回收碘,实验步骤为:检漏、混合、振荡、放气、静置、分层、分液等;
(4)由避热可知不稳定,易分解;
(5)碘与氯酸钾发生置换反应可制得碘酸钾和氯气.
解答 解:(1)碘在碘酸钾中的化合价为+5,1mol碘酸钾中共含5mol原子,K为+1价,0为-2价,则O原子应为3个,碘酸钾为KIO3,故答案为:KIO3;
(2)I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,由电子守恒及质量守恒定律可知,反应为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,
故答案为:KIO3;5;3;3;3;3;
(3)①要使上述反应生成的I2从溶液中分离出来,应先检漏,装入药品后充分振荡,静置后分层,故答案为:检漏:充分振荡;静置;
②用烧杯接收下层I2的有机溶液,说明萃取剂的密度比水大,一般可用四氯化碳,
故答案为:四氯化碳;
③从含碘的有机溶液中提取碘和回收有机溶液,可用蒸馏的方法分离,故答案为:蒸馏;
(4)由避热可知不稳定,易分解,故答案为:不稳定,受热易分解;
(5)碘与氯酸钾发生置换反应可制得碘酸钾和氯气,该反应为I2+2KClO3=2KIO3+Cl2,故答案为:I2+2KClO3=2KIO3+Cl2.
点评 本题以信息的形式考查碘及其化合物的性质,为高频考点,侧重于学生的分析能力的考查,涉及化学式、氧化还原反应、萃取等,注重学生知识迁移应用能力的考查,题目难度中等.

练习册系列答案
相关题目
9.下列各选项中的反应①与反应②不能用同一离子方程式表示的是( )
| 序号 | 反应① | 反应② |
| A | 向AgNO3溶液中滴加稀盐酸 | AgNO3溶液与食盐水混合 |
| B | 过量CO2通入NaOH溶液中 | 过量CO2通入澄清石灰水中 |
| C | 向烧碱溶液中滴加稀盐酸 | 向H2SO4溶液中滴加KOH溶液 |
| D | 向BaCl2溶液中滴加稀硫酸 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
1.设阿伏加德罗常数为NA.则下列说法正确的是( )
| A. | 1mol Cl2与常温下氢氧化钠溶液充分反应时转移的电子数为2NA | |
| B. | 1molCu与足量的硫固体反应转移的电子数为NA | |
| C. | 常温下,1 L 0.1 mol/L MgCl2溶液中含Mg2+数为0.1NA | |
| D. | 标准状况下,2.24L三氧化硫所含分子数为0.1 NA |
18.下列微粒中,属于阳离子的是( )
| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
5.下列说法中,正确的是( )
| A. | 分子数相同的气体,它们的体积一定相等 | |
| B. | 高温时,气体体积一定比低温时的体积大 | |
| C. | 相同状况下,物质的量相同的两种气体的体积相同 | |
| D. | 压强大时,气体体积一定比压强小时的体积小 |
15.有关下如图所示原电池的叙述不正确的是( )
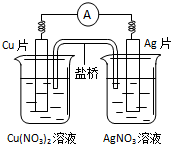

| A. | 电子沿导线由Cu片流向Ag片 | |
| B. | 正极的电极反应是Ag++e-=Ag | |
| C. | Cu片上发生氧化反应,Ag片上发生还原反应 | |
| D. | 反应时盐桥中的阳离子移向Cu(NO3)2溶液 |
2.在下列物质中,既能使溴水褪色,又能使酸性高锰酸钾溶液褪色,还能使紫色石蕊试液变为红色的是( )
| A. | 苯 | B. | 苯酚 | C. | 丙烯酸 | D. | 甲酸甲酯 |
19.世界卫生组织对塑化剂DEHP(分子式为C24H38O4)规定的每日耐受摄入量为每千克0.025毫克,以体重为78kg的成人来讲,每天摄入1.95毫克及以下的DEHP是安全的.体重为78kg的成人每天摄入下列DEHP时,不安全的是(设NA为阿伏加德罗常数的值)( )
| A. | 5×10-6NA个DEHP分子 | |
| B. | 含有1.2×10-4NA个碳原子的DEHP分子 | |
| C. | 含有2×10-5NA个氧原子的DEHP分子 | |
| D. | 含有2.0×10-4NA个氢原子的DEHP分子 |
20.比较下列各组性质,其中错误的是( )
| A. | 还原性:S2-<Cl-<F- | B. | 稳定性:HF>HCl>H2S | ||
| C. | 碱性:KOH<NaOH<Al(OH)3 | D. | 还原性:K>Na>Mg |