题目内容
3.同温同压下,甲容器内充满了H2气体,乙容器内充满了NH3气体,如果两者氢原子个数相等,则这两个容器的体积比为( )| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 3:1 |
分析 在相同条件下,气体的Vm相等,根据n=$\frac{V}{Vm}$=$\frac{N}{{N}_{A}}$计算.
解答 解:在相同条件下,气体的Vm相等,根据分子中含有的H原子个数可知分子数之比为3:2,
由n=$\frac{V}{Vm}$=$\frac{N}{{N}_{A}}$可知,同温同压下,气体的分子数之比等于体积之比,则体积比为3:2,
故选:A.
点评 本题考查阿伏加德罗定律及其推论,题目难度不大,注意分子的构成特点以及物质的量的相关计算公式的运用.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
2.120℃时,将4.0L CH4、C2H4和CH3CH2OH混合气体与10.0L O2混合,引燃,三种有机物恰好完全燃烧,产物恢复原来温度并通过足量碱石灰,没有气体剩余.则原混合气体中CH4、C2H4和CH3CH2OH的体积比可能是( )
| A. | 1:1:1 | B. | 4:1:3 | C. | 2:5:2 | D. | 2:1:2 |
11.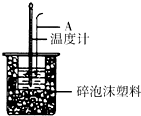 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.7kJ/mol
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac
a.实验装置保温、隔热效果差
b.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.7kJ/mol
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 25.0 | 25.2 | 28.5 | |
| 2 | 24.9 | 25.1 | 28.4 | |
| 3 | 25.5 | 26.5 | 31.8 | |
a.实验装置保温、隔热效果差
b.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
18.下列微粒中,属于阳离子的是( )
| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
8.下列叙述中正确的是( )
| A. | 常温常压下,18 g H2O含有的原子数为NA | |
| B. | 1.8 g的NH4+离子中含有的电子数为0.1 NA | |
| C. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| D. | 2.4 g金属镁变为镁离子时失去的电子数为0.2NA |
15.有关下如图所示原电池的叙述不正确的是( )
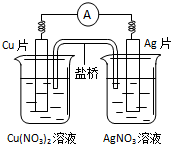

| A. | 电子沿导线由Cu片流向Ag片 | |
| B. | 正极的电极反应是Ag++e-=Ag | |
| C. | Cu片上发生氧化反应,Ag片上发生还原反应 | |
| D. | 反应时盐桥中的阳离子移向Cu(NO3)2溶液 |
12.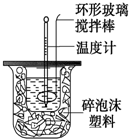 测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )
测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )
 测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )
测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )| A. | 实验中使用的搅拌棒材料为铁 | |
| B. | 读取温度计读数时,读取的是混合溶液的最高温度 | |
| C. | 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 | |
| D. | 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
13.、对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.若25℃时有HA?H++A-,则K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃).
回答下列问题:
(1)当升高温度时,K值变大(填“变大”“变小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?K值越大电离出的氢离子浓度越大,所以酸性越强.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是H3PO4,最弱的是HPO42-.
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是K1:K2:K3≈1:10-5:10-10,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(5)Na2CO3溶液呈碱性(填“酸性”“碱性”或“中性”),其原因(用离子方程式表示)是CO32-+H2O?HCO3-+OH-.
(6)已知NaH2PO4溶液呈酸性,则该溶液中c(H3PO4)小于c(HPO42-)(填“大于”或“小于”).
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COOH-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-HCO3-?H++HCO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS-HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4-H2PO4-H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3K2=6.23×10-8 K3=2.20×10-13 |
(1)当升高温度时,K值变大(填“变大”“变小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?K值越大电离出的氢离子浓度越大,所以酸性越强.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是H3PO4,最弱的是HPO42-.
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是K1:K2:K3≈1:10-5:10-10,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(5)Na2CO3溶液呈碱性(填“酸性”“碱性”或“中性”),其原因(用离子方程式表示)是CO32-+H2O?HCO3-+OH-.
(6)已知NaH2PO4溶液呈酸性,则该溶液中c(H3PO4)小于c(HPO42-)(填“大于”或“小于”).