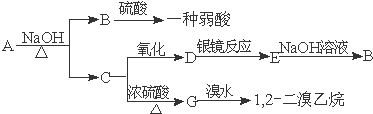
题目内容
17.下表是25℃时四种酸的电离平衡常数:| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
(2)25℃时,向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5.
(3)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),.
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2,某同学分别取少量NaCl与NaNO2与试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法可行(填“可行”或“不可行”),理由是NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行.
分析 (1)用离子方程式表示NaNO2溶液是强碱弱酸盐,水解溶液呈碱性;
(2)根据醋酸的电离平衡常数进行计算;
(3)由电离平衡常数可知,酸性H2CO3>HA>HCO3-,所以NaA溶液中通少量CO2的离子方程式为:A-+CO2+H2O=HA+HCO3-;
(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,HA的Ka=4.9×10-10,所以NaA的水解Kh=$\frac{1×1{0}^{-14}}{4.9×1{0}^{-10}}$>Ka,所以水解大于电离,以水解为主溶液呈碱性,由此得出离子浓度的大小;
(5)醋酸微弱电离出氢离子与NO2-结合成HNO2,而HNO2不稳定,在稀溶液中也易分解生成NO与生成红棕的NO2,由此分析解答.
解答 解:(1)用离子方程式表示NaNO2溶液是强碱弱酸盐,水解溶液呈碱性,方程式为:NO2-+H2O?HNO2+OH-,故答案为:NO2-+H2O?HNO2+OH-;
(2)醋酸的电离平衡常数Ka=1.8×10-5=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,已知c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5×$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=1×10-5mol/L,则该溶液的pH=5,故答案为:5;
(3)由电离平衡常数可知,酸性H2CO3>HA>HCO3-,所以NaA溶液中通少量CO2的离子方程式为:A-+CO2+H2O=HA+HCO3-,故答案为:A-+CO2+H2O=HA+HCO3-;(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,HA的Ka=4.9×10-10,所以NaA的水解Kh=$\frac{1×1{0}^{-14}}{4.9×1{0}^{-10}}$>Ka,所以水解大于电离,以水解为主溶液呈碱性,所以离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(5)醋酸微弱电离出氢离子与NO2-结合成HNO2,而HNO2不稳定,在稀溶液中也易分解生成NO与生成红棕的NO2,故答案为:可行,NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行.
点评 本题考查了弱电解质的电离平衡、电离平衡常数的有关计算、离子浓度大小比较等知识,题目难度中等,明确弱电解质的电离平衡、盐的水解原理为解答关键,注意明确电离平衡常数的概念及计算方法,试题培养了学生的分析能力及化学计算能力.

| A. | “84”消毒液可以与福尔马林溶液混合使用 | |
| B. | NaClO的稳定性和漂白性都比HClO强 | |
| C. | 工业上在特定条件下电解饱和食盐水制得NaClO,原理为:NaCl+H2O═NaClO+H2↑ | |
| D. | NaClO溶液在空气中发生离子反应为:2ClO-+CO2+H2O═2HClO+CO32- |
| A. | S$→_{燃烧}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | CuSO4(aq)$\stackrel{过量NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
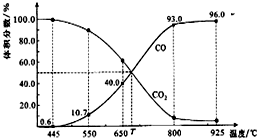 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )| A. | 550℃时,若充入惰性气体,v正,?逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为放热反应 |
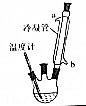 肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下:
肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下: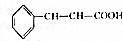 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$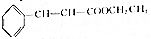 +H2O
+H2O | 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | 78.3 | 与水互溶 |
| 肉桂酸 | 148 | 1.245 | 300 | 微溶于水 |
| 肉桂酸乙酯 | 176 | 1.049 | 270 | 不溶于水 |
制取:①在三颈烧瓶中加入20.0g肉桂酸、50.0g乙醇、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热至约75℃,回流12h.②进行蒸馏.③进行减压蒸馏,精制.最终制得17.6g肉桂酸乙酯.
(1)步骤①中冷凝管的作用是冷凝回流.
(2)步骤②中进行蒸馏的目的是除去乙醇,制备过程中需要控制温度在75℃,常采用的方法是水浴加热.
(3)本实验中加入过量乙醇的目的是提高肉桂酸的转化率.
(4)若要分离肉桂酸乙酯和水的混合物,常采用的分离方法是分液,分离过程中需要用到的玻璃仪器有分液漏斗.下图给出蒸馏操作中,仪器选择及安装都正确的是D(填字母序号).

(5)本实验中肉桂酸的利用率是74%.
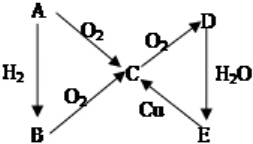 (有些反应条件均已省略,如加热、点燃等)则A的化学式可能是( )
(有些反应条件均已省略,如加热、点燃等)则A的化学式可能是( )| A. | N2 | B. | Cl2 | C. | S | D. | C |
| A. |  根据图可判断可逆反应A2(g)+3B2(g)═2AB3(g)的△H>0 | |
| B. | 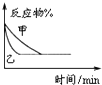 表示压强对可逆反应2A(g)+2B(g)═3C(g)+D(s)的影响,乙的压强大 | |
| C. | 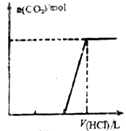 表示在含等物质的量NaOH、Na2CO3的混合溶液中逐滴加入0.1mol/L盐酸至过量时,产生气体的物质的量与消耗盐酸的体积关系 | |
| D. | 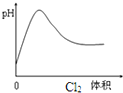 表示Cl2通入H2S溶液中pH变化 |