题目内容
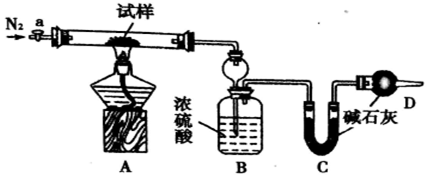
4.实验室需要配制0.1mol/LNaOH溶液450mL,有以下仪器①药匙;②100ml量筒;③500ml容量瓶;④锥形瓶;⑤玻璃棒;⑥烧杯(1)配制上述溶液,必须选用的仪器为:①③⑤⑥(填序号),配制上述溶液还需要的玻璃仪器为胶头滴管;
(2)经计算,本实验需称量NaOH2.0g;
(3)用NaOH配制标准溶液的正确顺序是(每项限选一次):BEAGCDF;
A冷却 B称量 C洗涤 D定容 E溶解 F摇匀 G移液
(4)将所配置溶液进行测定,发现浓度大于0.1mol/L.请你分析配制过程中可能引起该误差的原因是(填字母代号)②;
①容量瓶不干燥,含有少量蒸馏水;②定容时俯视刻度;③加水时不慎超过了刻度线,又将超出部分用吸管吸出;④称量时NaOH和砝码的位置放反,且使用了游码;⑤倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度;⑥配制溶液时称量NaOH时间过长;
(5)若定容时,所加入的蒸馏水超过容量瓶上的刻度线该如何处理:重新配制.
分析 (1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,以此确定需要的仪器;
(2)需要0.1mol/L的NaOH溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要溶质的质量;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据c=$\frac{n}{V}$进行误差分析;
(5)所加入的蒸馏水超过容量瓶上的刻度线,应重新配制.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,所以需要的玻璃仪器为:药匙、烧杯、500mL容量瓶、玻璃棒,还缺少的仪器:胶头滴管,
故答案为:①③⑤⑥;胶头滴管;
(2)需要0.1mol/L的NaOH溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g;
故答案为:2.0;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为BEAGCDF,故答案为:BEAGCDF;
(4)①容量瓶不干燥,含有少量蒸馏水,对实验无影响;
②定容时俯视刻度,导致体积偏小,浓度偏大;
③加水时不慎超过了刻度线,又将超出部分用吸管吸出,但浓度偏小;
④称量时NaOH和砝码的位置放反,且使用了游码,导致氢氧化钠质量偏小,则浓度偏小;
⑤倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度,体积偏大,浓度偏小;
⑥配制溶液时称量NaOH时间过长,发生变质生成碳酸钠,导致氢氧化钠浓度偏小,
故答案为:②;
(5)所加入的蒸馏水超过容量瓶上的刻度线,应重新配制,故答案为:重新配制.
点评 本题考查了一定物质的量浓度溶液的配制,为高频考点,侧重于学生的分析能力和实验能力的考查,明确配制过程及有关物质的量浓度计算是解题关键,注意误差分析的方法,题目难度不大.

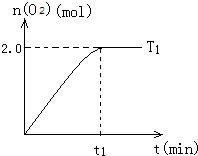 一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:
一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
(2)T1温度下,该反应的平衡常数表达式为:K=$\frac{{c}^{2}({H}_{2})×c({O}_{2})}{{c}^{2}({H}_{2}O)}$
(3)在T2温度时,K=0.4,T1> T2(填“>”“<”“=”)
(4)T1温度下,t1时刻达到平衡时的图象大致为:(见图I)
请在图I中画出降温至T0后,t0min达到平衡时的大致图象,并作必要的简单标注.
(5)H2可作氢氧燃料电池的反应物质,请写出在酸性介质中,氢氧燃料电池的负极反应式:H2-2e-=2H+.
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法.已知:
①C(s)+O2 (g)=CO2 (g)△H=-393.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△H=-283.0kJ•mol-1
③H2(g)+$\frac{1}{2}$O2 (g)=H2O (g)△H=-241.8kJ•mol-1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol,该反应的化学平衡常数K随温度的升高将增大(填“增大”、“减小”或“不变”).
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.在甲、乙两个恒容密闭容器中,起始时按照表数据进行投料,在800℃时达到平衡状态,K=1.0.
| H2O | CO | CO2 | H2 | |
| 甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| 乙 n/mol | 0.20 | 0.20 | 0 | 0 |
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸钠,写出工作时正极的电极反应式:O2+4e-+2CO2=2CO32-,若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下)6.72L.
(4)将(2)中生成的混合气用过量的NaOH溶液吸收,得到的溶液中有一种溶质可以水解,请写出其水解的离子方程式:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.