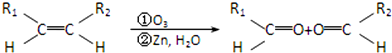
题目内容
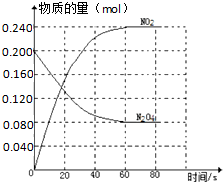 在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )
在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )| A、100℃时,在0-60s时段反应的平均反应速率v(N2O4)=0.002mol/(L?s) |
| B、100℃时,反应的平衡常数K为0.72mol?L-1 |
| C、100℃时达到平衡后,其它条件不变,仅改变反应温度为T,N2O4以0.001mol/(L?s)的平均速率变化,经10s又达到平衡,则T大于100℃ |
| D、保持反应体系的温度不变(100℃),再向该平衡体系中再加入一定量的N2O4,重新达平衡后,N2O4的体积分数与原平衡相等 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:A、根据反应速率v=
计算;
B、化学平衡常数利用化学平衡常数表达式计算;
C、N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
D、保持反应体系的温度不变(100℃),再向该平衡体系中再加入一定量的N2O4,相当于增大压强判断化学平衡移动方向.
| △c |
| △t |
B、化学平衡常数利用化学平衡常数表达式计算;
C、N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
D、保持反应体系的温度不变(100℃),再向该平衡体系中再加入一定量的N2O4,相当于增大压强判断化学平衡移动方向.
解答:
解:A、0~60s时段,N2O4浓度变化为:0.100mol/L-0.040mol/L=0.060mol/L,v(N2O4)=
=0.0010mol?L-1?s-1,故A错误;
B、K=
=
=0.36mol/L,故B错误;
C、N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故C正确;
D、保持反应体系的温度不变(100℃),再向该平衡体系中再加入一定量的N2O4,相当于增大压强向着气体体积减小的方向移动,增大压强平衡向逆方向移动,N2O4的体积分数增大,故D错误;
故选C.
| 0.060mol/L |
| 60s |
B、K=
| c2(NO2) |
| c(N2O4) |
| (0.120mol/L)2 |
| 0.04mol/L |
C、N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故C正确;
D、保持反应体系的温度不变(100℃),再向该平衡体系中再加入一定量的N2O4,相当于增大压强向着气体体积减小的方向移动,增大压强平衡向逆方向移动,N2O4的体积分数增大,故D错误;
故选C.
点评:本题考查了化学平衡的建立,影响平衡因素分析判断,注意图象的理解应用和平衡特征的应用,掌握基础是关键,题目难度中等.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是( )
| A、pH=3的醋酸和pH=11氢氧化钠溶液 |
| B、pH=2的硫酸和pH=12的氢氧化钠溶液 |
| C、pH=3的盐酸和pH=11的氨水 |
| D、pH=2的硝酸和pH=12的氢氧化钠溶液 |
下列物质中,熔融状态不能导电的电解质是( )
| A、Na2SO4 |
| B、NaOH |
| C、C2H5OH |
| D、H2SO4 |
下列变化:①导电、②爆炸、③缓慢氧化、④变色、⑤无水硫酸铜吸水、⑥工业制氧气、⑦白磷变成红磷、⑧久置浓HNO3变黄,一定属于化学变化的是( )
| A、①④ | B、⑥⑧ |
| C、②⑥⑦ | D、③⑤⑦⑧ |
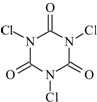 三氯异氰尿酸(结构简式如图)是一种极强的氧化剂和氯化剂.
三氯异氰尿酸(结构简式如图)是一种极强的氧化剂和氯化剂.