题目内容
下列变化:①导电、②爆炸、③缓慢氧化、④变色、⑤无水硫酸铜吸水、⑥工业制氧气、⑦白磷变成红磷、⑧久置浓HNO3变黄,一定属于化学变化的是( )
| A、①④ | B、⑥⑧ |
| C、②⑥⑦ | D、③⑤⑦⑧ |
考点:物理变化与化学变化的区别与联系
专题:
分析:化学变化的实质是在原子核不变的情况下,有新物质生成,分析各选项是否符合化学变化的概念,即有新物质生成,就是化学变化.
解答:
解:①导电:有物理变化如:金属导电.例如:铜通电后仍为铜,无新物质生成,但氯化钠溶液导电是化学变化,故①错误;
②自行车车胎爆炸是物理变化,是气压过大造成,故②错误;
③所有的氧化反应都是化学变化,缓慢氧化,是指氧化反应进行得比较缓慢,故③正确;
④活性炭吸附能使溶液褪色,是物理变化,故④错误;
⑤无水硫酸铜由白变蓝,原来白色是硫酸铜,变蓝是生成了五水合硫酸铜,有新物质生成,是化学变化,故⑤正确;
⑥工业制氧气,方法是先将空气降温加压液化,然后降压升温,先变成气体的是氮气,剩余的主要是氧气,过程是液化和气化,无新物质生成,故⑥错误;
⑦白磷有毒,红磷无毒,两者是不同的物质,白磷转化为红磷,是化学变化,故⑦正确;
⑧久置浓硝酸变黄发生反应:4HNO3
2H2O+4NO2↑+O2↑,生成的二氧化氮溶解其中呈黄色,故⑧正确;
故选D.
②自行车车胎爆炸是物理变化,是气压过大造成,故②错误;
③所有的氧化反应都是化学变化,缓慢氧化,是指氧化反应进行得比较缓慢,故③正确;
④活性炭吸附能使溶液褪色,是物理变化,故④错误;
⑤无水硫酸铜由白变蓝,原来白色是硫酸铜,变蓝是生成了五水合硫酸铜,有新物质生成,是化学变化,故⑤正确;
⑥工业制氧气,方法是先将空气降温加压液化,然后降压升温,先变成气体的是氮气,剩余的主要是氧气,过程是液化和气化,无新物质生成,故⑥错误;
⑦白磷有毒,红磷无毒,两者是不同的物质,白磷转化为红磷,是化学变化,故⑦正确;
⑧久置浓硝酸变黄发生反应:4HNO3
| ||
故选D.
点评:本题考查物理变化和化学变化,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 mol NH4+ 所含质子数为10NA |
| B、CO2的摩尔质量为44 g |
| C、常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
| D、标准状况下,22.4 LHCl溶于水形成1L溶液,所得溶液中溶质的物质的量浓度为22.4 mol/L |
中学化学中很多“规律”都有其使用范围,据有关“规律”下列推论合理的是( )
| A、根据较强酸可以制取较弱酸的规律,漂白粉溶液中通入过量的SO2的反应原理:ClO-+SO2+H2O═HSO3-+HClO | ||||
B、根据金属镁可以通过电解MgCl2制得,则工业制铝原理:2AlCl3
| ||||
| C、根据FeBr2溶液中通入少量Cl2使溶液变黄,则FeI2溶液中通入少量Cl2的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | ||||
| D、MgCl2中通足量氨水,有白色沉淀生成,则AlCl3中通足量氨水的离子方程式为:Al3++3NH3?H2O═Al(OH)3+3NH4+ |
质子数和中子数相同的原子A,其阳离子An+核外共有x个电子,则A的质量数为( )
| A、2(x+n) | B、2(x-n) |
| C、2x | D、n+2x |
同温同压下,等质量的下列气体所占有的体积最大的是( )
| A、H2 |
| B、N2 |
| C、SO2 |
| D、Cl2 |
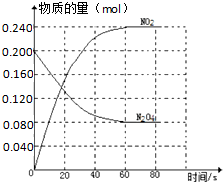 在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )
在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )| A、100℃时,在0-60s时段反应的平均反应速率v(N2O4)=0.002mol/(L?s) |
| B、100℃时,反应的平衡常数K为0.72mol?L-1 |
| C、100℃时达到平衡后,其它条件不变,仅改变反应温度为T,N2O4以0.001mol/(L?s)的平均速率变化,经10s又达到平衡,则T大于100℃ |
| D、保持反应体系的温度不变(100℃),再向该平衡体系中再加入一定量的N2O4,重新达平衡后,N2O4的体积分数与原平衡相等 |
 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答: