题目内容
铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2
2PbO+2SO2;③制粗铅:PbO+C
Pb+CO;PbO+CO
Pb+CO2.下列说法正确的是( )
| ||
| ||
| ||
| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO |
| C.整个冶炼过程中,制取1molPb共转移2mol电子 |
| D.将1molPbS冶炼成Pb理论上至少需要6g碳 |
考点:氧化还原反应
专题:
分析:A.没有新物质生成的变化属于物理变化,有新物质生成的变化属于化学变化;
B.2PbS+3O2
2PbO+2SO2中S元素化合价由-2价变为+4价、O元素化合价由0价变为-2价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物;
C.根据元素化合价变化计算转移电子物质的量;
D.将1molPbS冶炼成Pb的过程中,根据方程式得出:2PbS~2PbO~C~2Pb,根据Pb和C之间的关系式计算C的质量.
B.2PbS+3O2
| ||
C.根据元素化合价变化计算转移电子物质的量;
D.将1molPbS冶炼成Pb的过程中,根据方程式得出:2PbS~2PbO~C~2Pb,根据Pb和C之间的关系式计算C的质量.
解答:
解:A.浮选法富集方铅矿的过程没有新物质生成,属于物理变化,故A错误;
B.方铅矿焙烧反应2PbS+3O2
2PbO+2SO2中S元素化合价由-2价变为+4价、O元素化合价由0价变为-2价,所以PbS是还原剂,O2是氧化剂,则还原产物有PbO和SO2,故B错误;
C.整个冶炼过程中,根据Pb原子守恒,则PbS转化为PbO转移电子是2mole-,PbO转化为Pb转移电子是2mole-,所以制取1molPb共转移4mol电子,故C错误;
D.将1molPbS冶炼成Pb的过程中,根据方程式得出:2PbS~2PbO~C~2Pb,1molPbS冶炼成Pb理论上至少需要0.5mol的碳,其质量=0.5mol×12g/mol=6g,故D正确;
故选D.
B.方铅矿焙烧反应2PbS+3O2
| ||
C.整个冶炼过程中,根据Pb原子守恒,则PbS转化为PbO转移电子是2mole-,PbO转化为Pb转移电子是2mole-,所以制取1molPb共转移4mol电子,故C错误;
D.将1molPbS冶炼成Pb的过程中,根据方程式得出:2PbS~2PbO~C~2Pb,1molPbS冶炼成Pb理论上至少需要0.5mol的碳,其质量=0.5mol×12g/mol=6g,故D正确;
故选D.
点评:本题考查氧化还原反应、物理变化及化学变化,侧重考查基本概念、基本理论,明确元素化合价变化是解本题关键,注意C中转移电子的计算方法,题目难度不大.

练习册系列答案
相关题目
下列各组热化学方程式中,△H1>△H2的是( )
A、C(s)+O2(g)═CO2(g)△H1 C(s)+
| ||
| B、S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | ||
C、2H2(g)+O2(g)═2H2O(l)△H1 H2(g)+
| ||
| D、CaCO3(s)═CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)═Ca(OH)2(s)△H2 |
下列有关能源与能量的说法正确的是( )
| A、煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源 |
| B、蒸汽属于一次能源 |
| C、凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应 |
| D、反应物和生成物的总能量决定反应是放热还是吸热 |
深秋雨后的清晨,我们常会遇到大雾天气,雾中小液滴直径范围是( )
| A、小于1 nm |
| B、在1~100 nm间 |
| C、大于100 nm |
| D、无法确定 |
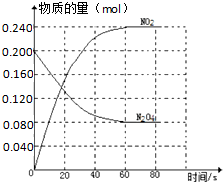 在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )
在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )| A、100℃时,在0-60s时段反应的平均反应速率v(N2O4)=0.002mol/(L?s) |
| B、100℃时,反应的平衡常数K为0.72mol?L-1 |
| C、100℃时达到平衡后,其它条件不变,仅改变反应温度为T,N2O4以0.001mol/(L?s)的平均速率变化,经10s又达到平衡,则T大于100℃ |
| D、保持反应体系的温度不变(100℃),再向该平衡体系中再加入一定量的N2O4,重新达平衡后,N2O4的体积分数与原平衡相等 |
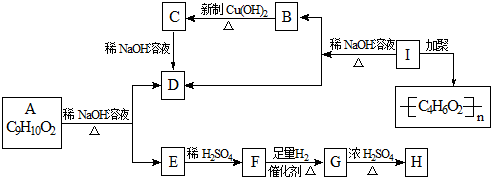
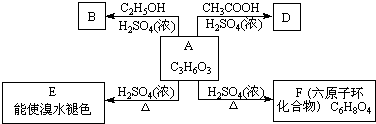
 .化学式为C9H10O2的有机物A有如下的转化关系:
.化学式为C9H10O2的有机物A有如下的转化关系: