��Ŀ����
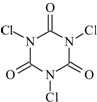 �����������ᣨ�ṹ��ʽ��ͼ����һ�ּ�ǿ�����������Ȼ�����
�����������ᣨ�ṹ��ʽ��ͼ����һ�ּ�ǿ�����������Ȼ�������1������������������ˮ������е�����������X�����������X�ķ���ʽΪ
��2������Ч�ȡ�����ָ��KI����������ͬ����I2����Cl2��������ָ�������������֮�ȣ����ٷ�����ʾ��Ϊ�ⶨ������������ġ���Ч�ȡ��������ֳ�ȡij��������������Ʒ0.5680g����ˮ������KI�����ᣬ���Ƴ�100mL����Һ��ȷ��ȡ25.00mL����Һ�ڵ���ƿ�У���0.1500mol?L-1 Na2S2O3����Һ�ζ�����Һ����ɫʱ���������ָʾ���������ζ����յ㣨������Ӧ�ķ���ʽΪ��2Na2S2O3+I2�TNa2S4O6+2NaI�����ظ��ⶨ2�Σ����õ�����������±���
| �ζ���� | ����Һ���/mL | ��Һ�ζ���������/mL | ��Һ�ζ����յ����/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
������0.1500mol?L-1 Na2S2O3��Һ100mL������Na2S2O3?5H2O������Ϊ
�ۼ������Ʒ�ġ���Ч�ȡ�������д��������̣�
���㣺̽�����ʵ���ɻ�������ʵĺ���,�л�������еĹ����ż���ṹ
ר�⣺ʵ��̽�������ݴ�����
��������1��������������ˮ������е�����������X������������ɸ����ʵ�Ԫ����ɷ�����
��2���ٵ��������ⵥ�ʱ���ɫ���������յ�ʱ�ⵥ����ȫ��Ӧ��
�ڸ���n=cV��m=nM���㣻
�۸��ݷ�Ӧ��Cl2+2I-�T2Cl-+I2��2Na2S2O3+I2�TNa2S4O6+2NaI �����������������������Ʒ�ġ���Ч�ȡ�������
��2���ٵ��������ⵥ�ʱ���ɫ���������յ�ʱ�ⵥ����ȫ��Ӧ��
�ڸ���n=cV��m=nM���㣻
�۸��ݷ�Ӧ��Cl2+2I-�T2Cl-+I2��2Na2S2O3+I2�TNa2S4O6+2NaI �����������������������Ʒ�ġ���Ч�ȡ�������
���
�⣺��1�������������� ˮ������е�����������X������������ɸ����ʵ�Ԫ����ɿ�֪ˮ������HClO���ʴ�Ϊ��HClO��
ˮ������е�����������X������������ɸ����ʵ�Ԫ����ɿ�֪ˮ������HClO���ʴ�Ϊ��HClO��
��2����ȷ��ȡ25.00mL����Һ������ƿ�У���0.1500mol?L-1 Na2S2O3����Һ�ζ�����Һ����ɫʱ���������ָʾ������Һ����ɫ�������ζ����յ㣨������Ӧ�ķ���ʽΪ��2Na2S2O3+I2�TNa2S4O6+2NaI�����������յ�ʱ�ⵥ����ȫ��Ӧ����Һ����ɫ��ȥ��
�ʴ�Ϊ����Һ��ɫ��ȥ����30s�ڲ���ɫ��
������0.1500mol?L-1 Na2S2O3��Һ100mL����n=cV=0.1500mol?L-1��0.1L=0.015mol������Na2S2O3?5H2O������Ϊm=nM=0.015mol��248g/mol=3.72 g��
�ʴ�Ϊ��3.72 g��
�۵�3�����ı�Na2S2O3��Һ�����ƫ��ϴ���ȥ�������ε�ƽ��ֵΪ24.03 mL��
���ݷ�Ӧ��
Cl2+2I-�T2Cl-+I2��2Na2S2O3+I2�TNa2S4O6+2NaI
��֪��
n��Cl2��=��
��0.1500 mol?L-1��24.03��10-3 L����
=7.2��10-3 mol��
m��Cl2��=7.2��10-3 mol��71 g?mol-1=0.5112 g��
�����������ᡰ��Ч�ȡ�����=
��100%=90%��
�ʴ�Ϊ��90%��
 ˮ������е�����������X������������ɸ����ʵ�Ԫ����ɿ�֪ˮ������HClO���ʴ�Ϊ��HClO��
ˮ������е�����������X������������ɸ����ʵ�Ԫ����ɿ�֪ˮ������HClO���ʴ�Ϊ��HClO����2����ȷ��ȡ25.00mL����Һ������ƿ�У���0.1500mol?L-1 Na2S2O3����Һ�ζ�����Һ����ɫʱ���������ָʾ������Һ����ɫ�������ζ����յ㣨������Ӧ�ķ���ʽΪ��2Na2S2O3+I2�TNa2S4O6+2NaI�����������յ�ʱ�ⵥ����ȫ��Ӧ����Һ����ɫ��ȥ��
�ʴ�Ϊ����Һ��ɫ��ȥ����30s�ڲ���ɫ��
������0.1500mol?L-1 Na2S2O3��Һ100mL����n=cV=0.1500mol?L-1��0.1L=0.015mol������Na2S2O3?5H2O������Ϊm=nM=0.015mol��248g/mol=3.72 g��
�ʴ�Ϊ��3.72 g��
�۵�3�����ı�Na2S2O3��Һ�����ƫ��ϴ���ȥ�������ε�ƽ��ֵΪ24.03 mL��
���ݷ�Ӧ��
Cl2+2I-�T2Cl-+I2��2Na2S2O3+I2�TNa2S4O6+2NaI
��֪��
n��Cl2��=��
| 1 |
| 2 |
| 100ml |
| 25ml |
m��Cl2��=7.2��10-3 mol��71 g?mol-1=0.5112 g��
�����������ᡰ��Ч�ȡ�����=
| 0.5112g |
| 0.5680g |
�ʴ�Ϊ��90%��
������������������������Ϊ���壬����ѧ�����Ķ���������������Ϣ�����������ؿ������ȼ��仯��������ʣ�ע������Cl2��I2��2Na2S2O3��ϵʽ���㣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д�
�����Ŀ
���з�Ӧ������������ԭ��Ӧ����ˮ�Ȳ����������ֲ�����ԭ�����ǣ�������
| A��SO3+H2O=H2SO4 |
| B��Cl2+H2O=HCl+HClO |
| C��2F2+2H2O=4HF+O2 |
| D��2Na+2H2O=2NaOH+H2�� |
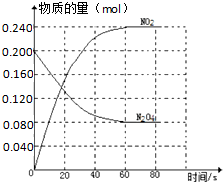 ���ݻ��̶�Ϊ2.00L���ܱ������У�ͨ��һ������N2O4��������ӦN2O4��g��?2NO2��g����H��0��100��ʱ��ϵ�и����ʵ�����mol����ʱ��仯��ͼ��ʾ��������
���ݻ��̶�Ϊ2.00L���ܱ������У�ͨ��һ������N2O4��������ӦN2O4��g��?2NO2��g����H��0��100��ʱ��ϵ�и����ʵ�����mol����ʱ��仯��ͼ��ʾ��������| A��100��ʱ����0-60sʱ�η�Ӧ��ƽ����Ӧ����v��N2O4��=0.002mol/��L?s�� |
| B��100��ʱ����Ӧ��ƽ�ⳣ��KΪ0.72mol?L-1 |
| C��100��ʱ�ﵽƽ��������������䣬���ı䷴Ӧ�¶�ΪT��N2O4��0.001mol/��L?s����ƽ�����ʱ仯����10s�ִﵽƽ�⣬��T����100�� |
| D�����ַ�Ӧ��ϵ���¶Ȳ��䣨100�棩�������ƽ����ϵ���ټ���һ������N2O4�����´�ƽ���N2O4�����������ԭƽ����� |
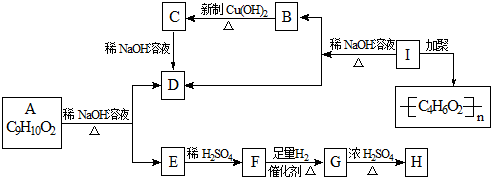
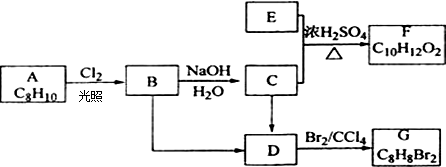
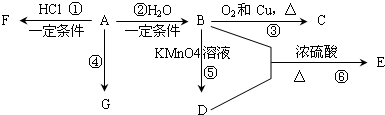
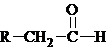 ����ѧʽΪC9H10O2���л���A�����µ�ת����ϵ��
����ѧʽΪC9H10O2���л���A�����µ�ת����ϵ��