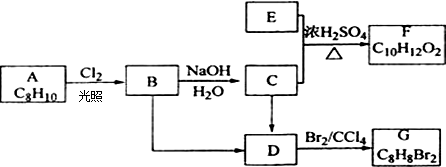
题目内容
下列物质中,熔融状态不能导电的电解质是( )
| A、Na2SO4 |
| B、NaOH |
| C、C2H5OH |
| D、H2SO4 |
考点:电解质与非电解质
专题:
分析:在水溶液里或熔融状态下能导电的化合物是电解质,不能导电的电解质物质没有自由离子,据此分析解答.
解答:
A、熔融的硫酸钠中存在自由移动的钠离子和硫酸根离子,是能导电的电解质,故A不选;
B、熔融的氢氧化钠中存在自由移动的钠离子和氢氧根离子,是能导电的电解质,故B不选;
C、乙醇是非电解质,不导电,故C不选;
D、液态硫酸中不存在自由移动的离子不导电,但在水溶液中能电离出氢离子和硫酸根离子能导电,属于电解质,故D选
故选D.
B、熔融的氢氧化钠中存在自由移动的钠离子和氢氧根离子,是能导电的电解质,故B不选;
C、乙醇是非电解质,不导电,故C不选;
D、液态硫酸中不存在自由移动的离子不导电,但在水溶液中能电离出氢离子和硫酸根离子能导电,属于电解质,故D选
故选D.
点评:本题考查了电解质的概念,难度不大,注意电解质不一定导电,导电的物质不一定是电解质.本题熔融状态不导电的电解质应是共价化合物形成的电解质,离子型化合物电解质在熔融状态都导电.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、塑料垃圾可直接露天焚烧 |
| B、实施“禁塑令”有助于遏制白色污染 |
| C、纤维素、油脂、蛋白质均属于有机高分子 |
| D、聚丙烯结构简式为:-[CH2-CH2-CH2]n- |
下列氧化还原反应中,得失电子情况表示不正确的是( )
A、 |
B、 |
C、 |
D、 |
下列反应中属于氧化还原反应,伹水既不作氧化剂又不作还原剂的是( )
| A、SO3+H2O=H2SO4 |
| B、Cl2+H2O=HCl+HClO |
| C、2F2+2H2O=4HF+O2 |
| D、2Na+2H2O=2NaOH+H2↑ |
中学化学中很多“规律”都有其使用范围,据有关“规律”下列推论合理的是( )
| A、根据较强酸可以制取较弱酸的规律,漂白粉溶液中通入过量的SO2的反应原理:ClO-+SO2+H2O═HSO3-+HClO | ||||
B、根据金属镁可以通过电解MgCl2制得,则工业制铝原理:2AlCl3
| ||||
| C、根据FeBr2溶液中通入少量Cl2使溶液变黄,则FeI2溶液中通入少量Cl2的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | ||||
| D、MgCl2中通足量氨水,有白色沉淀生成,则AlCl3中通足量氨水的离子方程式为:Al3++3NH3?H2O═Al(OH)3+3NH4+ |
下列有关能源与能量的说法正确的是( )
| A、煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源 |
| B、蒸汽属于一次能源 |
| C、凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应 |
| D、反应物和生成物的总能量决定反应是放热还是吸热 |
质子数和中子数相同的原子A,其阳离子An+核外共有x个电子,则A的质量数为( )
| A、2(x+n) | B、2(x-n) |
| C、2x | D、n+2x |
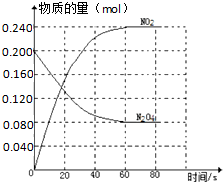 在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )
在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )| A、100℃时,在0-60s时段反应的平均反应速率v(N2O4)=0.002mol/(L?s) |
| B、100℃时,反应的平衡常数K为0.72mol?L-1 |
| C、100℃时达到平衡后,其它条件不变,仅改变反应温度为T,N2O4以0.001mol/(L?s)的平均速率变化,经10s又达到平衡,则T大于100℃ |
| D、保持反应体系的温度不变(100℃),再向该平衡体系中再加入一定量的N2O4,重新达平衡后,N2O4的体积分数与原平衡相等 |