题目内容
根据金属活动性顺序分析,下列描述或判断错误的是( )
| A、常温下,在空气中金属镁比铁容易氧化 |
| B、在氧气中灼烧时,铁丝比铜丝反应剧烈 |
| C、与同种盐酸反应时,锌片比铁片反应剧烈 |
| D、铜活动性不强,故铜不能与硝酸银溶液反应得到银 |
考点:常见金属的活动性顺序及其应用
专题:
分析:A.Mg比Fe活泼;
B.Fe比Cu活泼;
C.金属越活泼,与盐酸反应越剧烈;
D.Cu比Ag活泼.
B.Fe比Cu活泼;
C.金属越活泼,与盐酸反应越剧烈;
D.Cu比Ag活泼.
解答:
解:A.Mg比Fe活泼,则常温下在空气中金属镁比铁容易氧化,故A正确;
B.Fe比Cu活泼,则在氧气中灼烧时,铁丝比铜丝反应剧烈,故B正确;
C.金属越活泼,与盐酸反应越剧烈,Zn比Fe活泼,则与同种盐酸反应时,锌片比铁片反应剧烈,故C正确;
D.Cu比Ag活泼,则铜能与硝酸银溶液反应得到银,故D错误;
故选D.
B.Fe比Cu活泼,则在氧气中灼烧时,铁丝比铜丝反应剧烈,故B正确;
C.金属越活泼,与盐酸反应越剧烈,Zn比Fe活泼,则与同种盐酸反应时,锌片比铁片反应剧烈,故C正确;
D.Cu比Ag活泼,则铜能与硝酸银溶液反应得到银,故D错误;
故选D.
点评:本题考查金属活泼性及应用,为基础性习题,把握金属活动性顺序及反应的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
实验室可用NaNO2+NH4Cl═NaCl+N2↑+2H2O制备N2,下列说法正确的是( )
| A、NaNO2发生氧化反应 |
| B、NH4Cl中的氮元素被还原 |
| C、N2既是氧化产物,又是还原产物 |
| D、每生成1mol N2转移电子的物质的量为6mol |
下列各项操作中,发生“先产生沉淀,后沉淀又溶解”现象的是( )
①向AlCl3溶液中通入过量的NH3
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向水玻璃中逐滴加入过量的盐酸
④向Ca(OH)2溶液中通入过量的CO2.
①向AlCl3溶液中通入过量的NH3
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向水玻璃中逐滴加入过量的盐酸
④向Ca(OH)2溶液中通入过量的CO2.
| A、②④ | B、①④ | C、①③ | D、①② |
 常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- ).根据图示判断,下列说法正确的是
常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- ).根据图示判断,下列说法正确的是( )
| A、当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B、等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大 |
| C、A点溶液显中性 |
| D、向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
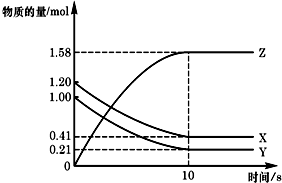 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A、应开始到10 s时,Y的转化率为79.0% |
| B、应的化学方程式为:X(g)+Y(g)=Z(g) |
| C、应开始到10 s,用Z表示的反应速率为0.158mol/(L?s) |
| D、开始到10 s,X的物质的量浓度减少了0.79mol/L |
常温下,若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A、生成了一种强酸弱碱盐 |
| B、强酸溶液和弱碱溶液反应 |
| C、弱酸溶液和强碱溶液反应 |
| D、一元强酸溶液和一元强碱溶液反应 |

