题目内容
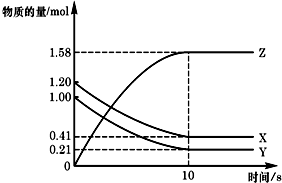 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A、应开始到10 s时,Y的转化率为79.0% |
| B、应的化学方程式为:X(g)+Y(g)=Z(g) |
| C、应开始到10 s,用Z表示的反应速率为0.158mol/(L?s) |
| D、开始到10 s,X的物质的量浓度减少了0.79mol/L |
考点:化学平衡的计算
专题:化学平衡专题
分析:根据图象知,随着反应的进行,X、Y的物质的量减小,Z的物质的量增加,说明X、Y是反应物,Z是生成物,达到平衡时△n(X)=(1.20-0.41)mol=0.79mol,△n(Y)=(1.00-0.21)mol=0.79mol,△n(Z)=(1.58-0)mol=1.58mol,同一反应中同一时间段内各物质的物质的量变化之比等于其计量数之比,据此写化学方程式,根据相关概念及公式进行反应速率、转化率的计算,据此答题.
解答:
解:根据图象知,随着反应的进行,X、Y的物质的量减小,Z的物质的量增加,说明X、Y是反应物,Z是生成物,达到平衡时△n(X)=(1.20-0.41)mol=0.79mol,△n(Y)=(1.00-0.21)mol=0.79mol,△n(Z)=(1.58-0)mol=1.58mol,
A、10s时Y的物质的量是0.21mol,所以变化量是0.79mol,所以转化率是79%,A正确;
B、根据变化量之比是相应的化学计量数之比可知方程式为X(g)+Y(g) 2Z(g),B错误;
2Z(g),B错误;
C、根据图象可知,用Z表示的反应速率为
=0.079 mol/(L?s),故C错误;
D、10s时X的物质的量是0.41mol,所以变化量是0.79mol,浓度的变化量是0.365mol/L,D错误;
故选A.
A、10s时Y的物质的量是0.21mol,所以变化量是0.79mol,所以转化率是79%,A正确;
B、根据变化量之比是相应的化学计量数之比可知方程式为X(g)+Y(g)
 2Z(g),B错误;
2Z(g),B错误;C、根据图象可知,用Z表示的反应速率为
| ||
| 10s |
D、10s时X的物质的量是0.41mol,所以变化量是0.79mol,浓度的变化量是0.365mol/L,D错误;
故选A.
点评:本题考查化学平衡图象问题,题目难度不大,注意分析图象中各物理量的变化曲线,把握相关物理量的计算.

练习册系列答案
相关题目
下列各反应的化学反应方程式或离子反应方程式中,属于水解反应的是( )
| A、CO32-+H2O═HCO3-+OH- |
| B、HCO3-+H2O═CO32-+H3O+ |
| C、CO2+H2O═H2CO3 |
| D、H2O+H2O═H3O++OH- |
向NaI和NaBr混合液中通入足量氯气,充分反应后将溶液蒸干,灼烧上述残留物,最后得到的物质是( )
| A、NaCl、I2 |
| B、NaCl、NaBr |
| C、NaBr、I2 |
| D、NaCl |
根据金属活动性顺序分析,下列描述或判断错误的是( )
| A、常温下,在空气中金属镁比铁容易氧化 |
| B、在氧气中灼烧时,铁丝比铜丝反应剧烈 |
| C、与同种盐酸反应时,锌片比铁片反应剧烈 |
| D、铜活动性不强,故铜不能与硝酸银溶液反应得到银 |
符号“3Px”没有给出的信息是( )
| A、能级 | B、电子层 |
| C、电子云伸展方向 | D、电子的自旋 |
下列实验操作正确的是( )
| A、硫酸钠中含有少量碳酸钠,加入盐酸除去碳酸钠杂质 |
| B、萃取时,将酒精和碘化钾溶液放入分液漏斗中静置分层 |
| C、用分液漏斗分离互不相容的两种液体时,先放出下层液体,然后再放出上层液体 |
| D、配制一定物质的量浓度溶液定容时,用胶头滴管滴加蒸馏水至溶液凹液面最低点与刻度线相切 |
北京奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运会更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关.下列说法中正确的是( )
| A、焰色反应均应透过蓝色钴玻璃观察 |
| B、NaC1与Na2CO3灼烧时火焰颜色相同 |
| C、做焰色反应实验时,用稀硫酸洗涤铂丝 |
| D、所有金属及其化合物灼烧时火焰均有颜色 |