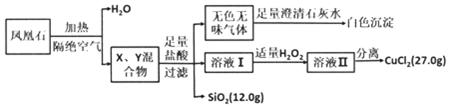
题目内容
6.实现下列变化,需要加入还原剂的是( )| A. | N2→NO | B. | HNO3→NO | C. | BaCl2→BaSO4 | D. | Fe2+→Fe3+ |
分析 需要加入还原剂才能实现,则选项中氧化剂在反应中元素的化合价降低,以此来解答.
解答 解:A.N元素化合价升高,被氧化,应加入氧化剂,故A错误;
B.N元素化合价降低,被还原,应加入还原剂,故B正确;
C.元素化合价没有发生变化,不是氧化还原反应,故C错误;
D.Fe元素化合价升高,被氧化,应加入氧化剂,故D错误.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化解答的关键,侧重还原反应的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
14.向等物质的量浓度的ZnSO4和CuSO4的混合溶液中,逐滴加入1.5mol•L-1的Na2S溶液直至溶液中无沉淀产生,然后过滤.已知:Ksp(ZnS)=2.0×10-22,Ksp(CuS)=1.3×10-36.下列说法不正确的是( )
| A. | 先生成CuS后生成ZnS沉淀,属于沉淀的转化 | |
| B. | 当ZnS沉淀完全时,溶液中$\frac{{c(C{u^{2+}})}}{{c(Z{n^{2+}})}}$=6.5×10-15 | |
| C. | 过滤得到的沉淀是CuS和ZnS的混合物 | |
| D. | 过滤后得到的溶液中仍有极少量的Cu2+和Zn2+ |
18.下列说法中,正确的是( )
| A. | H35Cl、H37Cl属于同素异形体 | |
| B. | 稳定性:CH4>SiH4;还原性:HCl>H2S | |
| C. | 16O与 18O的中子数不同,核外电子排布却相同 | |
| D. | K+、Ca2+、Mg2+的离子半径依次增大 |
15.下列关于乙烯和乙烷的说法中,不正确的是( )
| A. | 乙烯属于不饱和链烃,乙烷属于饱和链烃 | |
| B. | 乙烯分子中所有原子处于同一平面上,乙烷分子中的原子不在同一平面上 | |
| C. | 乙烯分子中的 双键比乙烷分子中的 C-C 单键更稳定,性质更活泼 | |
| D. | 乙烯能使酸性 KMnO4 溶液褪色,乙烷不能 |
16.瑞典皇家科学院曾将诺贝尔化学奖授予“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家.下列分子中含有“手性碳原子”的是( )
| A. | CBr2F2 | B. | CH3CH(OH)COOH | C. | CH3CH2CH3 | D. | CH3CH2OH |
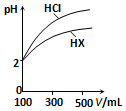 水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题: