题目内容
11.彩电荧光屏中的蓝色荧光粉含有ZnS.将含有0.05mol ZnS的荧光粉溶于500mL盐酸中,完全溶解后,溶液中c(S2-)≤-2.5×10-22mol•L-1.已知:KsP(ZnS)=2.5×10-23,忽略溶液体积的变化)分析 将含有0.05mol ZnS的荧光粉溶于500mL盐酸中,完全溶解后溶液中锌离子浓度c(Zn2+)=$\frac{0.05mol}{0.5L}$=0.1mol/L,结合溶度积常数计算该题.
解答 解:将含有0.05mol ZnS的荧光粉溶于500mL盐酸中,完全溶解后溶液中锌离子浓度c(Zn2+)=$\frac{0.05mol}{0.5L}$=0.1mol/L,
Ksp(ZnS)=2.5×10-23=c(Zn2+)×c(S2-),
c(S2-)≤2.5×10-22mol/L,
故答案为:2.5×10-22.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析、计算能力的考查,答题时注意把握溶度积的理解和运用,结合溶度积计算该题,题目难度中等.

练习册系列答案
相关题目
1. 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和溶液中加入K2CrO4可使溶液由Y点到Z点 | |
| C. | 在t℃时,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀 |
2.设 NA 表示阿伏加德罗常数的数值,下列叙述中正确的是( )
| A. | 1 mol NH3所含有的电子数为 17NA | |
| B. | 常温常压下,22.4 L 氧气所含的原子数为 2NA | |
| C. | 常温常压下,48g O3 所含的氧原子数为 3NA | |
| D. | 1 mol/L NaCl 溶液中所含的 Na+数为 NA |
19.下列说法正确的是( )
| A. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 正四面体分子晶体内的键角一定是109°28′ | |
| C. | CuSO4溶液能使蛋白质溶液产生沉淀,该过程可用于提纯蛋白质 | |
| D. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}{H}_{2}O)}{c(N{H}_{{4}^{+}})}$的值增大 |
6.实现下列变化,需要加入还原剂的是( )
| A. | N2→NO | B. | HNO3→NO | C. | BaCl2→BaSO4 | D. | Fe2+→Fe3+ |
3.下列排列顺序不正确的是( )
| A. | 离子半径:Al3+<Mg2+<F-<O2- | B. | 热稳定性:SiH4>NH3>H2O>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
20.10mL某种气态烃,在50mL氧气中完全燃烧,得到液态水和体积为35mL的混合气体(所有气体体积都是在同温同压下测定),则下列烃中符合题意的烃是( )
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
1.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A. | Fe3+、H+、SO42-、ClO- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、SO42-、CO32- | D. | K+、H+、Br-、MnO4- |
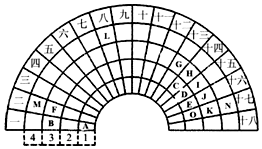 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题: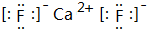 ,用电子式表示CJ2的形成过程:
,用电子式表示CJ2的形成过程: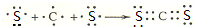 .
.