题目内容
14.向等物质的量浓度的ZnSO4和CuSO4的混合溶液中,逐滴加入1.5mol•L-1的Na2S溶液直至溶液中无沉淀产生,然后过滤.已知:Ksp(ZnS)=2.0×10-22,Ksp(CuS)=1.3×10-36.下列说法不正确的是( )| A. | 先生成CuS后生成ZnS沉淀,属于沉淀的转化 | |
| B. | 当ZnS沉淀完全时,溶液中$\frac{{c(C{u^{2+}})}}{{c(Z{n^{2+}})}}$=6.5×10-15 | |
| C. | 过滤得到的沉淀是CuS和ZnS的混合物 | |
| D. | 过滤后得到的溶液中仍有极少量的Cu2+和Zn2+ |
分析 A.等物质的量浓度的ZnSO4和CuSO4的混合溶液,Ksp小的先沉淀;
B.当ZnS沉淀完全时,溶液中$\frac{{c(C{u^{2+}})}}{{c(Z{n^{2+}})}}$=$\frac{Ksp(CuS)}{Ksp(ZnS)}$;
C.逐滴加入1.5mol•L-1的Na2S溶液直至溶液中无沉淀产生,可知Cu2+和Zn2+均转化为沉淀;
D.难溶电解质存在溶解平衡,且离子浓度为1×10-5mol/L时认为离子完全沉淀.
解答 解:A.等物质的量浓度的ZnSO4和CuSO4的混合溶液,Ksp小的先沉淀,均为沉淀的生成,不发生沉淀的转化,故A错误;
B.当ZnS沉淀完全时,溶液中$\frac{{c(C{u^{2+}})}}{{c(Z{n^{2+}})}}$=$\frac{Ksp(CuS)}{Ksp(ZnS)}$=$\frac{1.3×1{0}^{-36}}{2.0×1{0}^{-22}}$=6.5×10-15,故B正确;
C.逐滴加入1.5mol•L-1的Na2S溶液直至溶液中无沉淀产生,可知Cu2+和Zn2+均转化为沉淀,则过滤得到的沉淀是CuS和ZnS的混合物,故C正确;
D.难溶电解质存在溶解平衡,且离子浓度为1×10-5mol/L时认为离子完全沉淀,则过滤后得到的溶液中仍有极少量的Cu2+和Zn2+,故D正确;
故选A.
点评 本题考查难溶电解质,为高频考点,把握沉淀生成、Ksp的应用为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的易错点,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
5.下列过程:①电离,②电解,③电镀,④电化腐蚀,需要通电才能进行的是( )
| A. | ①②③④ | B. | 只有②③④ | C. | 只有①②③ | D. | 只有②③ |
2.设 NA 表示阿伏加德罗常数的数值,下列叙述中正确的是( )
| A. | 1 mol NH3所含有的电子数为 17NA | |
| B. | 常温常压下,22.4 L 氧气所含的原子数为 2NA | |
| C. | 常温常压下,48g O3 所含的氧原子数为 3NA | |
| D. | 1 mol/L NaCl 溶液中所含的 Na+数为 NA |
19.下列说法正确的是( )
| A. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 正四面体分子晶体内的键角一定是109°28′ | |
| C. | CuSO4溶液能使蛋白质溶液产生沉淀,该过程可用于提纯蛋白质 | |
| D. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}{H}_{2}O)}{c(N{H}_{{4}^{+}})}$的值增大 |
6.实现下列变化,需要加入还原剂的是( )
| A. | N2→NO | B. | HNO3→NO | C. | BaCl2→BaSO4 | D. | Fe2+→Fe3+ |
3.下列排列顺序不正确的是( )
| A. | 离子半径:Al3+<Mg2+<F-<O2- | B. | 热稳定性:SiH4>NH3>H2O>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
4.表为周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述,正确的是( )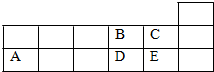

| A. | 它们的简单离子半径大小关系为:A>D>E>B>C | |
| B. | 氧化物的水化物的酸性强弱关系:E>D>A | |
| C. | 化合物E2B的分子中B原子的杂化方式为sp3 | |
| D. | 工业上将E单质通入澄清石灰水中反应制漂白粉 |
