题目内容
18.下列说法中,正确的是( )| A. | H35Cl、H37Cl属于同素异形体 | |
| B. | 稳定性:CH4>SiH4;还原性:HCl>H2S | |
| C. | 16O与 18O的中子数不同,核外电子排布却相同 | |
| D. | K+、Ca2+、Mg2+的离子半径依次增大 |
分析 A.同素异形体的分析对象为单质;
B.非金属性越强,对应氢化物越稳定、氢化物的还原性越弱;
C.O的质子数均为8,核外电子排布相同;
D.电子层越多,离子半径越大;具有相同电子排布的离子中,原子序数大的离子半径小.
解答 解:A.H35Cl、H37Cl为一种化合物,故A错误;
B.非金属性C>Si,则稳定性:CH4>SiH4;非金属性Cl>S,则还原性:HCl<H2S,故B错误;
C.16O与 18O的中子数分别为8、10,质子数均为8,则核外电子排布相同,故C正确;
D.K+、Ca2+、Mg2+的离子半径依次减小,故D错误;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
8.一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡.下列说法正确的是( )
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
| Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
| Ⅱ | 758 | 0.1 | 0.05 | 0 | |
| Ⅲ | 858 | 0.2 | 0.1 | 0 | |
| A. | 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol•L-1•s-1 | |
| B. | 平衡时,容器Ⅱ中SO3的浓度小于0.022 mol•L-1 | |
| C. | 平衡时,容器Ⅲ中SO3的浓度大于0.044 mol•L-1 | |
| D. | 若起始时,向容器Ⅰ中充入0.02 mol SO2,0.01 mol O2和0.02 mol SO3,则反应向逆反应方向进行 |
6.实现下列变化,需要加入还原剂的是( )
| A. | N2→NO | B. | HNO3→NO | C. | BaCl2→BaSO4 | D. | Fe2+→Fe3+ |
3.下列排列顺序不正确的是( )
| A. | 离子半径:Al3+<Mg2+<F-<O2- | B. | 热稳定性:SiH4>NH3>H2O>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
10.下列物质中,与甲烷互为同系物的是( )
| A. | C2H4 | B. | C2H5OH | C. | C2H6 | D. | C6H6 |
8.下列过程中,没有发生化学变化的是( )
| A. | 燃放烟花爆竹 | B. | 积雪渐渐融化 | C. | 粮食用来酿酒 | D. | 食醋除去水垢 |

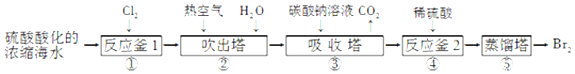
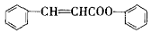 )是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
)是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
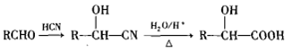
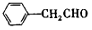 .
.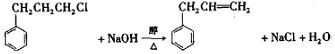 .
. .
. 或
或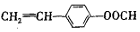 .(任写一种)
.(任写一种)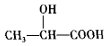 )的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
)的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).