题目内容
16.瑞典皇家科学院曾将诺贝尔化学奖授予“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家.下列分子中含有“手性碳原子”的是( )| A. | CBr2F2 | B. | CH3CH(OH)COOH | C. | CH3CH2CH3 | D. | CH3CH2OH |
分析 根据手性碳原子指连有四个不同基团的碳原子,手性碳原子判断注意:(1)手性碳原子一定是饱和碳原子;(2)手性碳原子所连接的四个基团要是不同的,据此进行解答.
解答 解:A.CBr2F2中碳原子所连接的四个基团有2个是一样的,该碳原子没有手性,故A错误;
B.CH3CH(OH)COOH中间的碳原子连有的4个不同取代基,该碳原子具有手性,故B正确;
C.CH3CH2CH3中两个C连接的四个基团有3个是一样的,另一个C连接的四个基团有2个是一样的,其分子中所有碳原子没有手性,故C错误;
D.CH3CH2OH中一个碳原子所连接的四个基团有3个是一样的,另一个碳原子所连接的四个基团有2个是一样的,碳原子没有手性,故D错误;
故选B.
点评 本题主要考查手性碳原子的判断,题目难度不大,明确含有“手性碳原子”的条件为解答关键,试题侧重基础知识的考查,有利于培养学生的灵活应用能力.

练习册系列答案
相关题目
6.实现下列变化,需要加入还原剂的是( )
| A. | N2→NO | B. | HNO3→NO | C. | BaCl2→BaSO4 | D. | Fe2+→Fe3+ |
4.表为周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述,正确的是( )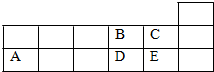

| A. | 它们的简单离子半径大小关系为:A>D>E>B>C | |
| B. | 氧化物的水化物的酸性强弱关系:E>D>A | |
| C. | 化合物E2B的分子中B原子的杂化方式为sp3 | |
| D. | 工业上将E单质通入澄清石灰水中反应制漂白粉 |
1.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A. | Fe3+、H+、SO42-、ClO- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、SO42-、CO32- | D. | K+、H+、Br-、MnO4- |
8.下列过程中,没有发生化学变化的是( )
| A. | 燃放烟花爆竹 | B. | 积雪渐渐融化 | C. | 粮食用来酿酒 | D. | 食醋除去水垢 |
5.下列说法正确的是( )
| A. | 1mol任何物质都约含有6.02×1023个原子 | |
| B. | 物质的量为2mol的BaCl2中,含有Cl-个数为2NA | |
| C. | O2的摩尔质量是32 | |
| D. | 摩尔是物质的量的单位 |
6.下列有关说法不正确的是( )
| A. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 己知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则水电离的热化学方程式为:H2O(l)?H+ (aq)+OH-(aq)△H=+57.3 kJ•mol-1 | |
| D. | 向0.1mol/L的CH3COONa溶液中加入少量醋酸钠固体,c(CH3COO-)/c(Na+ )变大 |
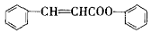 )是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
)是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
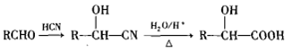
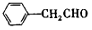 .
.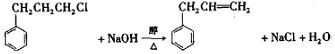 .
. .
. 或
或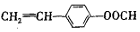 .(任写一种)
.(任写一种)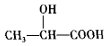 )的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
)的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).